题目内容
6.下列有关性质的比较正确的是( )| A. | 原子半径:P<S<Cl | B. | 非金属性:P>S>Cl | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>HCl |
分析 A.同一周期中,原子序数越大原子半径越小;
B.同一周期中,原子序数越大非金属性越强;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.非金属性越强,对应氢化物的稳定性越强.
解答 解:A.P、S、Cl位于第三周期,原子序数越大原子半径越小,则原子半径大小为:P>S>Cl,故A错误;
B.P、S、Cl位于第三周期,原子序数越大非金属性越强,则非金属性:P<S<Cl,故B错误;
C.非金属性P<S<Cl,则最高价氧化物对应水合物的酸性:H3PO4<H2SO4<HClO4,故C正确;
D.非金属性P<S<Cl,非金属性越强,氢化物越稳定,则稳定性:PH3<H2S<HCl,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
17.下列叙述不正确的是( )
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线 | |
| C. | 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| D. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 |
14.在氨水中存在电离平衡:NH3•H2O?NH4++OH-,下列情况能引起电离平衡向右移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水.
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水.
| A. | ①③⑤ | B. | ①④⑤ | C. | ③④⑤ | D. | ①②④ |
1.海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.通过海水资源的开发利用不能得到的是( )
| A. | 石油、天然气 | B. | 乙醇、乙酸 | C. | 淡水 | D. | 钠、钾、镁、溴 |
15.被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为Zn+2MnO2+H2O═ZnO+2MnO(OH)下列说法不正确的是( )
| A. | 该电池锌为负极,发生氧化反应 | |
| B. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 当该电池工作时,负极周围的pH值变大 |
17.下列各组顺序的排列正确的是( )
| A. | 最高正价:P<S<Cl<Ar | B. | 热稳定性:H2O>HF>HCl | ||
| C. | 酸性强弱:HNO3<H2CO3<H3PO4 | D. | 还原性 F-<Cl-<Br- |
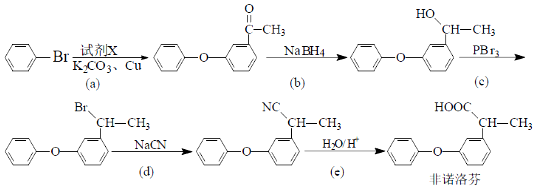
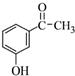 .
. .
. 某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.
某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.