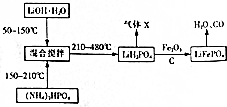
题目内容
5.化学与社会、生活和生产密切联系.下列物质的应用中不涉及电子转移的是( )| A. | 明矾、硫酸铁作净水器 | |
| B. | 医用双氧水做杀菌消毒剂 | |
| C. | 铁粉、碳粉和氯化钠的混合物作食品的去氧剂 | |
| D. | CaO2作运输水产品的供氧剂 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,据此分析.
解答 解:A.明矾、硫酸铁作净水是铝离子、铁离子水解生成氢氧化铝胶体和氢氧化铁胶体具有吸附悬浮杂质的作用,反应是水解反应,不涉及电子转移,故A选;
B.医用双氧水做杀菌消毒剂,双氧水具有强氧化性,反应中O元素的化合价都变化,涉及电子转移,故B不选;
C.铁粉、碳粉和氯化钠的混合物作食品的去氧剂,Fe元素的化合价变化,涉及电子转移,故C不选;
D.CaO2作运输水产品的供氧剂,O元素的化合价变化,所以属于氧化还原反应,涉及电子转移,故D不选;
故选A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| B. | 地沟油的主要成分是高级脂肪酸甘油酯.可用于制肥皂 | |
| C. | 石油分馏的目的是为了获得乙烯、丙烯和1,3-丁二稀 | |
| D. | 乙醇,过氧化氢和臭氧可用于消毒.均体现氧化性 |
16.如图所示与对应叙述不相符的是( )
| A. | 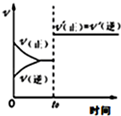 反应CO+NO2?CO2+NO达平衡后,增大压强时反应速率随时间的变化 | |
| B. | 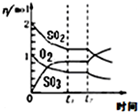 反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 | |
| C. | 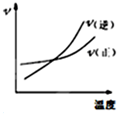 反应N2+3H 2?2NH3△H<0在恒容的容器中,反应速率与温度的关系 | |
| D. | 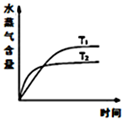 反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化 |
13.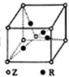 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
(1)基态R原子的电子排布式为1s22s22p63s23p63d104s1.
(2)Y2分子中σ键和π键的数目比为1:2.
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为C<O<N(用元素符合表示),元素Y的气态氢化物的沸点比元素X的气态氧化物沸点高的主要原因是氨气分子之间存在氢键.
(4)由元素Z、W组成的为了WZ43-的空间构型是正四面体,其中W原子的杂化物到类型为sp3杂化.
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为Cu2O,若相邻的Z原子核R原子间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$(用含a、NA的代数式表示)g•cm-1.
 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
(2)Y2分子中σ键和π键的数目比为1:2.
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为C<O<N(用元素符合表示),元素Y的气态氢化物的沸点比元素X的气态氧化物沸点高的主要原因是氨气分子之间存在氢键.
(4)由元素Z、W组成的为了WZ43-的空间构型是正四面体,其中W原子的杂化物到类型为sp3杂化.
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为Cu2O,若相邻的Z原子核R原子间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$(用含a、NA的代数式表示)g•cm-1.
10.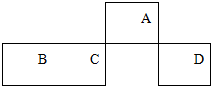 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )| A. | C元素在地壳中的含量仅次于氧元素 | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 元素A与元素B形成的化合物BA是一种新型无机非金属材料 | |
| D. | 实验室可用B的单质与A元素最高价氧化物对应的水化物反应制取氢气 |
17.加入少许金属钠后,溶液中哪种离子数目不会减少( )
| A. | Cu2+ | B. | Mg2+ | C. | SO42- | D. | HCO3- |
14.不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法正确的是( )
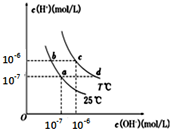

| A. | a点对应的溶液中大量存在:Na+、Mg2+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、Cl-、NO3- | |
| C. | c点对应的溶液中大量存在:K+、Al3+、Cl-、CO32- | |
| D. | d点对应的溶液中大量存在:Na+、NH4+、ClO-、Cl- |