题目内容
17.加入少许金属钠后,溶液中哪种离子数目不会减少( )| A. | Cu2+ | B. | Mg2+ | C. | SO42- | D. | HCO3- |
分析 钠与水反应生成氢氧化钠和氢气,也就是与氢氧化钠中的氢氧根离子反应的离子数目会显著减少进行分析.
解答 解:A、铜离子与氢氧根离子不能共存,故A错误;
B、镁离子与氢氧根离子生成氢氧化镁,而不能大量共存,故B错误;
C、硫酸根和氢氧化钠中的钠离子以及氢氧根离子均不反应,硫酸根离子数目不变,故C正确;
D.碳酸氢根离子和氢氧化钠中的氢氧根离子结合生成碳酸根离子和水,所以会减少,故D错误.
故选C.
点评 本题考查离子共存的问题,关键是对常见的离子性质及复分解反应发生的条件的准确掌握,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
8. 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
(1)请写出Fe的基态原子核外电子排布式1s22s22p63s23p63d64s2或[Ar]3d64s2.
(2)金属A的原子只有3个电子层,其第一至第四电离能如表:
则A原子的价电子排布式为3s2.
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为C<O<N
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为4
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子核N原子轨道的杂化类型分别为sp2、sp3;1mol尿素分子中,σ键的数目为7NA.
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大.
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾.其中NH4-的空间构型是正四面体(用文字描述),与NO3-互为等电子体的分子是SO3或者BF3.(填化学式)
(6)铜的化合物种类很多,如图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ=$\frac{260}{{a}^{3}•{N}_{A}}$g/cm3.(用NA表示阿佛加德罗常数)
 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.(1)请写出Fe的基态原子核外电子排布式1s22s22p63s23p63d64s2或[Ar]3d64s2.
(2)金属A的原子只有3个电子层,其第一至第四电离能如表:
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)]△H<0
①C、N、O三种元素的第一电离能由小到大的顺序为C<O<N
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为4
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子核N原子轨道的杂化类型分别为sp2、sp3;1mol尿素分子中,σ键的数目为7NA.
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,晶格能大.
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾.其中NH4-的空间构型是正四面体(用文字描述),与NO3-互为等电子体的分子是SO3或者BF3.(填化学式)
(6)铜的化合物种类很多,如图是氢化亚铜的晶胞结构,已知晶胞的棱长为acm,则氢化亚铜密度的计算式为ρ=$\frac{260}{{a}^{3}•{N}_{A}}$g/cm3.(用NA表示阿佛加德罗常数)
5.化学与社会、生活和生产密切联系.下列物质的应用中不涉及电子转移的是( )
| A. | 明矾、硫酸铁作净水器 | |
| B. | 医用双氧水做杀菌消毒剂 | |
| C. | 铁粉、碳粉和氯化钠的混合物作食品的去氧剂 | |
| D. | CaO2作运输水产品的供氧剂 |
9.对二甲苯 ( PX )是生产矿泉水瓶 (聚对苯二甲酸乙二酯,简称 PET )的必要原料,生产涉及的反应之一如下:
5 (PX)+12MnO4-+36H+→5
(PX)+12MnO4-+36H+→5  (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )
5
 (PX)+12MnO4-+36H+→5
(PX)+12MnO4-+36H+→5  (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过缩聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 10mol电子 |
6.下列叙述正确的是( )
| A. | 乙醛和甲酸两者都能发生银镜反应,所以它们互为同系物 | |
| B. | 营养物质中的多糖、油脂、蛋白质在一定条件下都可以发生水解 | |
| C. | 氨基酸和氯乙烯都能通过加聚反应生成高分子化合物 | |
| D. | 通过对煤的分馏,可以提高煤的利用率 |
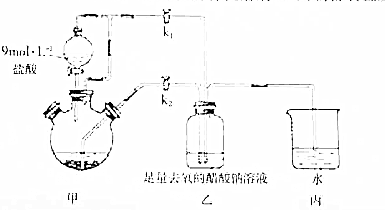 ①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液.
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液. 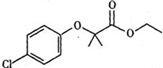 )是临床一种应用广泛的药物,它的一条合成路线如图:
)是临床一种应用广泛的药物,它的一条合成路线如图: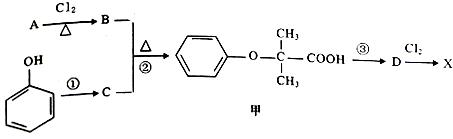
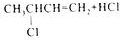
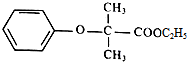 .
.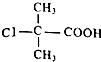 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$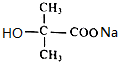 +NaCl+H2O.
+NaCl+H2O. CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
.