题目内容
1.用NA表示阿伏加德罗常数的数值,下列判断正确的是( )| A. | 1mo lCl2参加反应转移电子数一定为2NA | |
| B. | 一定条件下,足量铜与200g98%的浓硫敌充分反应,转移电子数为2NA | |
| C. | 300mL 2mol/L蔗糖溶液中所含蔗糖分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
分析 A.氯气与氢氧化钠反应生成氯化钠、和次氯酸钠;
B.铜与浓硫酸反应,与稀硫酸不反应;
C.依据N=CVNA计算解答;
D.氦气为单原子分子,氟气为双原子分子;
解答 解:A.氯气与氢氧化钠反应生成氯化钠、和次氯酸钠,1mol氯气参加反应转移电子数为1mol,故A错误;
B.随着反应进行,硫酸浓度降低变为稀硫酸,稀硫酸与铜不反应,所以转移电子数小于2NA,故B错误;
C.300mL 2mol/L蔗糖溶液中所含蔗糖分子数为0.3L×2mol/L×NA=0.6NA,故C正确;
D.氦气为单原子分子,氟气为双原子分子,标准状况下,22.4L氦气与22.4L氟气物质的量都是1mol,前者含有原子数为1NA,后者含有原子数为:2NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度中等,注意氦气为单原子分子.

练习册系列答案
相关题目
17.下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | ||
| C. | 熔融的KNO3、酒精 | D. | 液态的醋酸、硫酸溶液 |
14.下列有关化学用语表示正确的是( )
| A. | ${\;}_{8}^{16}$O2-离子的结构示意图: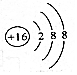 | |
| B. | 碳酸氢钠熔融时的电离方程式:NaHCO3?Na++HCO3- | |
| C. | 次氯酸的结构式:Cl-O-H | |
| D. | 过氧化氢的电子式: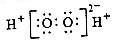 |
1.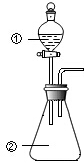 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 浓盐酸 | MnO2 | 产生黄绿色气体 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 酸化的FeCl2溶液 | H2O2溶液 | 溶液变成黄棕色,有气泡产生 |
| D | Fe2(SO4)3溶液 | 铜粉 | 溶液变蓝色,有黑色固体产生 |
| A. | A | B. | B | C. | C | D. | D |
6.生活因化学而精彩,化学因实验而生动,实验因“洗涤”而准确.以下关于对沉淀或晶体进行洗涤的说法错误的是( )
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,以提高固体的纯度 | |
| B. | 洗涤的操作是:向过滤器里的固体直接注入洗涤剂浸没固体,待洗涤剂自然流下即可 | |
| C. | 洗涤的试剂根据需要一般可选用蒸馏水、冰水、乙醇或该物质的饱和溶液 | |
| D. | 是否洗净的检验:取最后一次洗涤液,鉴别含有形成相应沉淀的该溶液中的离子 |
11.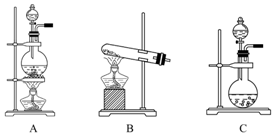 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:
(1)上述实验原理中,从反应中有无电子转移的角度看,明显不同于其他气体的是② (填编号),写出实验室常用的制取该气体的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其字母填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等)
(4)在浓CaCl2溶液中通入NH3和CO2可以制得碳酸钙,制取时应先通入的气体是NH3,该反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.
(5)制备8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为ACFGH
A.100mL量筒
B.托盘天平
C.玻璃棒
D.50mL容量瓶
E.10mL量筒
F.胶头滴管
G.100mL烧杯
H.100mL容量瓶
③下列实验操作中不正确的是BC (填写字母).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其字母填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等)
(4)在浓CaCl2溶液中通入NH3和CO2可以制得碳酸钙,制取时应先通入的气体是NH3,该反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.
(5)制备8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为ACFGH
A.100mL量筒
B.托盘天平
C.玻璃棒
D.50mL容量瓶
E.10mL量筒
F.胶头滴管
G.100mL烧杯
H.100mL容量瓶
③下列实验操作中不正确的是BC (填写字母).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.