题目内容
2.实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题: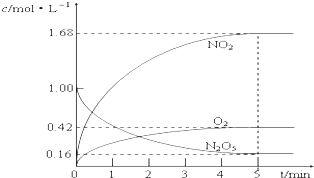 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2(2)0~5 min钟内,二氧化氮的平均反应速率v (NO2)=0.336mol/(L•min)
(3)0~2 min内v (N2O5)明显大于2~4min内的v(N2O5),原因是0~2 min内c (N2O5)大于2~4 min内的c(N2O5)
(4)该反应达到化学平衡状态时,反应物的转化率为84%.
分析 (1)根据图中的有关物质的浓度的变化可以判断反应物、生成物,及它们之间量的关系,进而写出化学方程式;
(2)根据$\frac{△c}{△t}$求速率;
(3)根据影响速率的因素可判断,浓度越大反应速率越快;
(4)反应物为N2O5,转化率=$\frac{消耗量}{起始量}$×100%.
解答 (1)由图象可知,在5min时,NO2的浓度增加了1.68mol/L,O2的浓度增加了0.42mol/L,N2O5的浓度减小了1-0.16=0.84mol/L,所以NO2、O2为生成物,N2O5为反应物,它们的变化的浓度之比=1.68:0.42:0.84=4:1:2,所以化学反应方程式为:2N2O5?4NO2+O2,
故答案为:2N2O5?4NO2+O2;
(2)v (NO2)=$\frac{△c}{△t}$=$\frac{1.68mol/L}{5min}$=0.336mol/(L•min),故答案为:0.336mol/(L•min);
(3)因为在0~2 min内反应物平均浓度要比2~4min内的反应物浓度要大,浓度越大反应速率越快,
故答案为:0~2 min内c (N2O5)大于2~4min内的c(N2O5);
(4)该反应达到化学平衡状态时,反应物的转化率=$\frac{1mol/L-0.16mol/L}{1mol/L}$×100%=84%,
故答案为:84%.
点评 本题考查了学生运用图象写方程式由此求得反应速率、判断影响速率的因素的能力,题目难度不大.关键是要注意图中的物理量的理解应用.

练习册系列答案
相关题目
13.将铁片投入下列溶液中,铁片溶解且可使溶液的质量增加的是( )
| A. | Na2SO4溶液 | B. | FeCl3溶液 | C. | Cu(NO3)2溶液 | D. | 稀硫酸 |
10.用托盘天平称取10.1g NaOH试样,下列操作中,正确的是( )
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平左边托盘上 | |
| C. | 用镊子取出标定为10.1 g的砝码放在天平右边的托盘上 | |
| D. | 用镊子取出标定为10 g的砝码放在天平左边的托盘上,并将游码向右移到0.1 g位置上 |
9.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
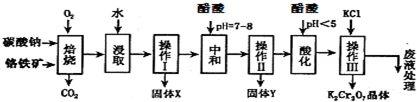
:①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2CO72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用PH计或PH试纸(填写仪器或试剂名称).
(2)酸化步骤调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:
Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).

:①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2CO72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用PH计或PH试纸(填写仪器或试剂名称).
(2)酸化步骤调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:
Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期. Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.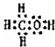 .
.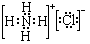 .
.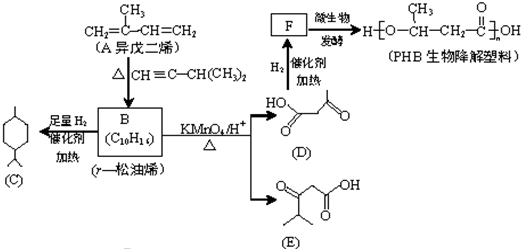
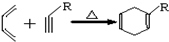 ,
,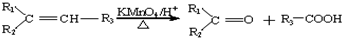 .
. .
.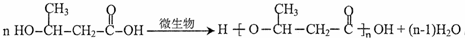 .
.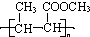 (一种类似有机玻璃的塑料).
(一种类似有机玻璃的塑料).