题目内容
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.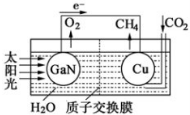
(1)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
①写出铜电极表面的电极反应式 .
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”).
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 .
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
2CO(g)+2H2(g).
①该反应的平衡常数表达式为 .
②在密闭容器中通入物质的量浓度均为0.1mol?L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图l所示,则压强P1 P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于“、“小于”或“等于“).
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2,则X的结构简式为 .


(1)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
①写出铜电极表面的电极反应式
②为提高该人工光合系统的工作效率,可向装置中加入少量
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
| ||
①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为0.1mol?L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图l所示,则压强P1
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2,则X的结构简式为

考点:化学电源新型电池,化学平衡的计算,有机物实验式和分子式的确定
专题:
分析:(1)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷;
②根据酸的挥发性分析;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质;
(3)①根据化学平衡常数表达的意义书写,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;
(4)已知X的相对分子质量为l06,设其分子式为CxHy,由
可知x=8,y=10,再根据质谱图中有2个峰,判断分子中含有2种环境的H.
②根据酸的挥发性分析;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质;
(3)①根据化学平衡常数表达的意义书写,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;
(4)已知X的相对分子质量为l06,设其分子式为CxHy,由
| 106 |
| 12 |
解答:
解:(1)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;
故答案为:CO2+8e-+8H+=CH4+2H2O;
②可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;
故答案为:硫酸;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质,则一定条件下向NH4HS溶液中通入空气,得到单质硫和氨水,则反应方程式为:2NH4HS+O2=2NH3?H2O+2S↓;
故答案为:2NH4HS+O2=2NH3?H2O+2S↓;
(3)①已知CO2(g)+CH4(g)
2CO(g)+2H2(g),其平衡常数表达式是K=
;
故答案为:K=
;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(4)芳香烃X,已知X的相对分子质量为l06,设其分子式为CxHy,由
可知x=8,y=10,说明分子中含有一个苯环,另外含有2个C原子,再根据质谱图中有2个峰,可知分子中含有2种环境的H,则分子结构对称,所以其结构简式为 ;
;
故答案为: .
.
故答案为:CO2+8e-+8H+=CH4+2H2O;
②可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;
故答案为:硫酸;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质,则一定条件下向NH4HS溶液中通入空气,得到单质硫和氨水,则反应方程式为:2NH4HS+O2=2NH3?H2O+2S↓;
故答案为:2NH4HS+O2=2NH3?H2O+2S↓;
(3)①已知CO2(g)+CH4(g)
| ||
| c2(CO)?c2(H2) |
| c(CO2)?c(CH4) |
故答案为:K=
| c2(CO)?c2(H2) |
| c(CO2)?c(CH4) |
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(4)芳香烃X,已知X的相对分子质量为l06,设其分子式为CxHy,由
| 106 |
| 12 |
 ;
;故答案为:
 .
.
点评:本题考查了原电池原理、方程式的书写、化学平衡常数、平衡移动、有机物分子式的确定等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关盐酸的说法中正确的是( )
| A、纯净的盐酸是纯净物 |
| B、盐酸就是液态氯化氢 |
| C、盐酸中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等 |
| D、浓盐酸有腐蚀性,稀盐酸没有腐蚀性 |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、1 mol AlCl3在熔融状态时离子总数为0.4NA |
| B、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA |
| C、2.2g分子式为 2H218O的水中含有的中子数为1.2 NA |
| D、电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA |
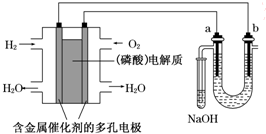 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,正极反应式为:O2+2H2O+4e-═4OH- |
| B、电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、忽略能量损耗,当电池中消耗0.2 g H2时,b极周围会产生2.24L H2 |
将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )
| A、1.5mL | B、2.4mL |
| C、3.6mL | D、4mL |
一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.20 molCl2和0.20 molCO,反应达到平衡前的速率:υ(正)>υ(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和1.2molCO,达到平衡时,Cl2的转化率大于60% |
 下图为教材铝热反应演示实验示意图
下图为教材铝热反应演示实验示意图