题目内容
17.一定条件下,将一定体积的H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含amol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含有Cl-、ClO-、ClO3-且三者物质的量之比为8:1:1,则:(1)原混合气体中Cl2的物质的量为$\frac{1}{2}$amol(用含a的数学式表示).
(2)氢气和氯气的物质的量之比为1:5.
分析 将混合气体通入含amolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3),溶液中Cl-、ClO-、ClO-3三者的物质的量之比为8:1:1,据此计算各离子物质的量,根据电子转移守恒,计算氯气发生氧化还原反应生成的氯离子的物质的量,溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,计算反应后混合气体中氯化氢的物质的量,根据氢元素守恒计算氢气的物质的量.
解答 解:(1)混合气体通入含amolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3),
根据氯元素守恒可知,
H2和Cl2的混合气体中n(Cl2)=$\frac{1}{2}$[n(Cl-)+n(ClO-)+n(ClO-3)]=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$amol,
故答案为:$\frac{1}{2}$amol;
(2)混合气体通入含amolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3),
由于溶液中Cl-、ClO-、ClO-3三者的物质的量之比为8:1:1,所以溶液中n(Cl-)=$\frac{4}{5}$amol,n(ClO-)=$\frac{1}{10}$amol,n(ClO-3)=$\frac{1}{10}$amol,
令氯气与氢氧化钠反应生成的氯离子的物质的量为xmol,根据电子转移守恒有x=$\frac{1}{10}$a+$\frac{1}{10}$amol×5=$\frac{3}{5}$amol,
溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为$\frac{4}{5}$amol-$\frac{3}{5}$amol=$\frac{1}{5}$mola,
即反应后的混合气体中n(HCl)=$\frac{1}{5}$amol,根据氢元素守恒可知,n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×$\frac{1}{5}$mola=0.1amol,
则氢气和氯气的物质的量之比0.1a:0.5a=1:5,
故答案为:1:5.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,判断溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO-3)是解题关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 0.4mol氧气 | B. | 4℃时5.4mL水 | C. | 10g Ne | D. | 5.6g CO |
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | “化学纯”是指这种硫酸只含H2SO4和H2O分子 | |
| D. | 配制460mL2.3mol•L-1的稀硫酸需量取该硫酸62.5 mL |
| A. | 做“钠与水的反应”实验时,切取绿豆粒大小的金属钠,用滤纸吸干表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 用蒸馏法提纯物质时,如果把温度计水银球位于蒸馏烧瓶支管口下方,会使收集的产品中混有低沸点的杂质 | |
| C. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸,加热3~5min,将导气管插入饱和Na2CO3溶液中以便于除去乙醇和乙酸 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
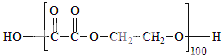 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等.将5.60g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88g.
①产生的氢气的体积为1792mL(标准状况下).
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量.
(2)Nierite是一种高熔点高硬度的陶瓷材料.Nierite的摩尔质量为140g/mol,其中硅元素的质量分数为60%.已知1mol NH3与足量的化合物T充分反应后可得到35g Nierite与3mol HCl气体.Nierite的化学式为Si3N4.T的化学式为SiCl4.
(3))K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属.为测定某18K金样品的组成,将2.832g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224mL(折算至标准状况,下同),将该混合气体与84mL O2混合后缓缓通入水中,恰好被完全吸收.
①混合气体的平均摩尔质量为69g/mol.
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0).
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长.现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长.
①共形成5条聚酯链.
②计算所得聚酯的平均式量.
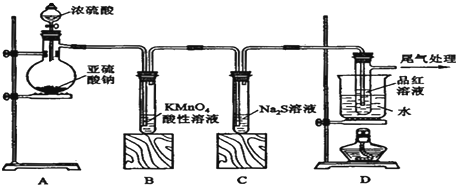
 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: .A单质的电子式为
.A单质的电子式为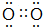 .
.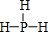 .
.