题目内容
9.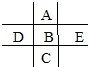 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:(1)C位于第四周期,VIA族.
(2)E的离子结构示意图
 .A单质的电子式为
.A单质的电子式为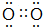 .
.(3)D、B、E的最高价氧化物对应水化物的分子式分别是:H3PO4 、H2SO4、HClO4,A、B的气态氢化物热稳定性是H2O>H2S(填化学式)
(4)D的气态氢化物的结构式为
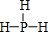 .
.
分析 B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,其最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+16×3}$=40%,解得:M=32,则B为S元素;根据各元素在周期表中的位置可知:A为O元素、D为P元素、E为Cl元素、C为Se元素,然后结合元素周期律的递变规律进行解答.
解答 解:B元素的最高正价是最低负价绝对值的3倍,则最高正价为+6价,其最高氧化物为BO3,其中含氧60%,设B的相对原子质量为M,则有$\frac{M}{M+16×3}$=40%,解得:M=32,则B为S元素;根据各元素在周期表中的位置可知:A为O元素、D为P元素、E为Cl元素、C为Se元素,
(1)C为Se元素,位于元素周期表中第四周期VIA族,
故答案为:四;VIA;
(2)E为Cl元素,其离子为Cl-,氯离子结构示意图为: ;A单质为O2,其电子式为
;A单质为O2,其电子式为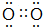 ,
,
故答案为: ;
;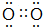 ;
;
(3)D、B、E分别为P、S、Cl元素,其最高氧化物对应水化物分别为:H3PO4、H2SO4、HClO4;
A、B所形成气态氢化物分别为H2O、H2S,同主族元素从上到下元素的非金属性逐渐减弱,非金属性越强,对应的氢化物越稳定,则氢化物稳定性为:H2O>H2S,
故答案为:H3PO4;H2SO4;HClO4;H2O;H2S;
(4)D的气态氢化物为PH3,与氨气的结构相似,其结构式为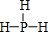 ,
,
故答案为: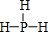 .
.
点评 本题考查位置结构性质的相互关系,题目难度中等,注意根据元素在周期表中的位置结合化合价特点进行推断,明确原子结构与元素周期律、元素周期表的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
16.海藻中含丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分,下列判断正确的是( )
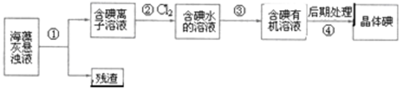

| A. | 步骤①、③的操作分别是过滤、萃取分液 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是过滤 |
14.常温下,下列各组离子在特定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba+、NO32-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
4.下列物质不属于高分子化合物的是( )
| A. | 蔗糖 | B. | 蛋白质 | C. | 淀粉 | D. | 聚乙烯 |
1.下列关于苯的叙述正确的是( )
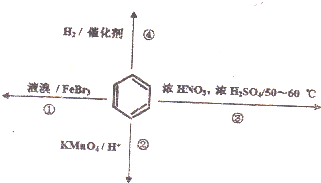

| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应,产物是无色液体 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
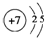 ;
;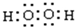 ,
,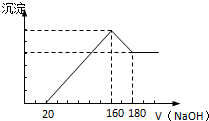 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)