题目内容
Na2CO3的制取方法及综合探究
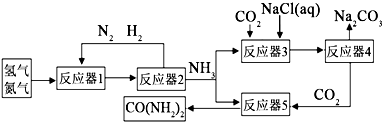
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
①向饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是
②从生产流程图可知,可循环利用的物质是
③写出沉淀池中、煅烧炉中反应的化学方程式
(2)如何用CO2和50mL 2mol?L-1NaOH溶液制取50mL 1mol?L-1Na2CO3溶液?
①写出简要的实验步骤
②写出有关反应的化学方程式 .
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:

①向饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是
②从生产流程图可知,可循环利用的物质是
③写出沉淀池中、煅烧炉中反应的化学方程式
(2)如何用CO2和50mL 2mol?L-1NaOH溶液制取50mL 1mol?L-1Na2CO3溶液?
①写出简要的实验步骤
②写出有关反应的化学方程式
考点:纯碱工业(侯氏制碱法),制备实验方案的设计
专题:
分析:(1)①从CO2在水中打的溶解度不大、而NH3极易溶于水来分析;
②联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,沉淀池中得到的为碳酸氢钠,加热分解生成碳酸钠、水和CO2;
③饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;高温下,碳酸氢钠不稳定易分解;
(2)①由于CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象,而NaHCO3+NaOH=Na2CO3+H2O,据此分析;
②根据配制过程来写出化学方程式.
②联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,沉淀池中得到的为碳酸氢钠,加热分解生成碳酸钠、水和CO2;
③饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;高温下,碳酸氢钠不稳定易分解;
(2)①由于CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象,而NaHCO3+NaOH=Na2CO3+H2O,据此分析;
②根据配制过程来写出化学方程式.
解答:
解:(1)①氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为HCO3-,故答案为:因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-;
②在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故答案为:CO2;
③在沉淀池氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、水和二氧化碳,反应方程式为 2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓、2NaHCO3
Na2CO3+H2O+CO2↑;
(2)①由于CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象,而NaHCO3+NaOH=Na2CO3+H2O,故可以取25 mL NaOH溶液通入过量的CO2气体使其转化为NaHCO3,
在排出二氧化碳后,然后在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合即得纯的碳酸钠.
故答案为:a、取25 mL NaOH溶液通入过量的CO2气体,至CO2不再溶解;
b、小心煮沸溶液1~2分钟,排出溶液中溶解的CO2气体;
c、在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合即得纯的碳酸钠;
②根据实验步骤可知,在NaOH溶液通入过量的CO2气体时发生反应:NaOH+CO2=NaHCO3;
得到的溶液中加入另一半(25 mL)NaOH溶液时,发生反应:NaHCO3+NaOH=Na2CO3+H2O;
故答案为:NaOH+CO2=NaHCO3、NaHCO3+NaOH=Na2CO3+H2O.
②在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故答案为:CO2;
③在沉淀池氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、水和二氧化碳,反应方程式为 2NaHCO3
| ||
故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓、2NaHCO3
| ||
(2)①由于CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象,而NaHCO3+NaOH=Na2CO3+H2O,故可以取25 mL NaOH溶液通入过量的CO2气体使其转化为NaHCO3,
在排出二氧化碳后,然后在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合即得纯的碳酸钠.
故答案为:a、取25 mL NaOH溶液通入过量的CO2气体,至CO2不再溶解;
b、小心煮沸溶液1~2分钟,排出溶液中溶解的CO2气体;
c、在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合即得纯的碳酸钠;
②根据实验步骤可知,在NaOH溶液通入过量的CO2气体时发生反应:NaOH+CO2=NaHCO3;
得到的溶液中加入另一半(25 mL)NaOH溶液时,发生反应:NaHCO3+NaOH=Na2CO3+H2O;
故答案为:NaOH+CO2=NaHCO3、NaHCO3+NaOH=Na2CO3+H2O.
点评:本题考查较为综合,涉及食盐的工业应用,注意把握工业制备原理和操作流程,结合物质的性质解答该题,牢固把握相关基础知识是解答该类题目的关键,题目难度不大.

练习册系列答案
相关题目
下面关于电解质的叙述中正确的是( )
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
下列说法不正确的是( )
| A、在稀氨水中滴加AgNO3溶液来配制银氨溶液,银氨溶液久置容易爆炸,要随配随用 |
| B、用标准NaOH溶液测定食醋中醋酸含量时应该使用酚酞作为指示剂 |
| C、将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯水具有强氧化性 |
| D、重结晶法提纯KNO3产品除去少量NaCl时,应在较高温度下溶解产品配成浓溶液后冷却结晶 |
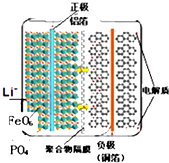 磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6
磷酸铁锂电池的内部结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池正极连接,中间是聚合物的隔膜,它把 正极与负极隔开,但锂离子Li+可以通过而电子电子不能通过,右边是由碳(石墨)组成的电池负极,由铜箔与电池的负极连接.电池的上下端之间是电池的电解质,电池由金属外壳密闭封装.电池的总反应为:Li1-xFePO4+LixC6| 放电 |
| 充电 |
| A、磷酸铁锂电池放电时,锂离子从负极中脱出来,经过电解液,穿过隔膜回到正极材料中 |
| B、放电时负极反应:C6Li-xe-═6C+xLi+ |
| C、充电时阳极反应:LiFePO4-xe-═Li1-xFePO4+xLi+ |
| D、若用该电池电解精炼粗铜,阳极质量减少12.8g时,则电池中通过聚合物隔膜的Li+数目为0.4NA |
关于三种有机物叙述错误的是(-SH的性质类似于-OH)( )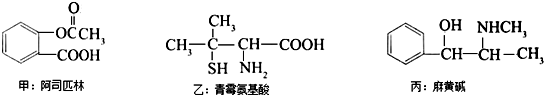
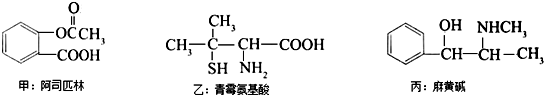
| A、都能发生酯化反应 |
| B、都能与NaOH反应 |
| C、甲的苯环上的一氯代物有4种 |
| D、丙的分子式为C10H15ON,苯环上的一氯代物有3种 |

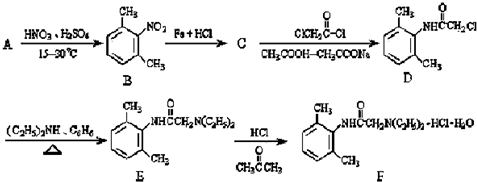
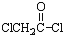 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: