题目内容
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.001mol?L-1KMnO4酸性溶液测定未知浓度的无色NaHSO3溶液(HSO3-电离大于水解)的浓度,反应离子方程式为2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O.
(1)该滴定实验所需玻璃仪器有下列中的 .
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.胶头滴管D.锥形瓶 E.漏斗
(2)是否需要指示剂,说明理由 .
(3)滴定过程中,NaHSO3溶液为待测液,每次取的体积是25.00mL,消耗0.100mol?L-1的酸性KMnO4溶液24.20mL,则NaHSO3溶液的物质的量浓度为 .
(1)该滴定实验所需玻璃仪器有下列中的
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.胶头滴管D.锥形瓶 E.漏斗
(2)是否需要指示剂,说明理由
(3)滴定过程中,NaHSO3溶液为待测液,每次取的体积是25.00mL,消耗0.100mol?L-1的酸性KMnO4溶液24.20mL,则NaHSO3溶液的物质的量浓度为
考点:中和滴定
专题:实验题
分析:(1)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,滴定过程还需要锥形瓶;
(2)高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为紫红色;
(3)结合化学方程式中参加反应的高锰酸根离子与亚硫酸氢根离子的物质的量之比,据c(测)=
计算.
(2)高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为紫红色;
(3)结合化学方程式中参加反应的高锰酸根离子与亚硫酸氢根离子的物质的量之比,据c(测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(1)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,滴定过程还需要锥形瓶,故答案为:AD;
(2)高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为紫红色,不用指示剂也能够观察滴定终点,故答案为:不需要,因为滴定终点时,溶液由无色变为紫红色;
(3)据方程式可知,参加反应的n(MnO4-):n(HSO3-)=2:5,所以c(测)=
=
×
=0.242mol/L,故答案为:0.242mol/L.
(2)高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为紫红色,不用指示剂也能够观察滴定终点,故答案为:不需要,因为滴定终点时,溶液由无色变为紫红色;
(3)据方程式可知,参加反应的n(MnO4-):n(HSO3-)=2:5,所以c(测)=
| c(标准)×V(标准) |
| V(待测) |
| 5 |
| 2 |
| 0.100mol/L×24.20mL |
| 25.00mL |
点评:本题主要考查了滴定操作中仪器的使用以及滴定计算,难度不大,理解掌握中和滴定、氧化还原滴定的原理是解题关键.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
用已知浓度的NaOH溶液滴定未知浓度的醋酸,下列情况,测得结果偏高的是( )
①用酚酞作指示剂
②滴定管用水洗后,未用标准溶液润洗就装入标准溶液
③锥形瓶盛待测液前,未用待测液润洗
④标准液读数时,滴定前仰视,滴定后俯视
⑤用于取待测液的滴定管未用待测液润洗
⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
⑦滴定达终点时发现滴定管尖嘴处挂着一滴液滴.
①用酚酞作指示剂
②滴定管用水洗后,未用标准溶液润洗就装入标准溶液
③锥形瓶盛待测液前,未用待测液润洗
④标准液读数时,滴定前仰视,滴定后俯视
⑤用于取待测液的滴定管未用待测液润洗
⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
⑦滴定达终点时发现滴定管尖嘴处挂着一滴液滴.
| A、①③④ | B、②③ |
| C、②⑦ | D、④⑤⑥ |
关于三种有机物叙述错误的是(-SH的性质类似于-OH)( )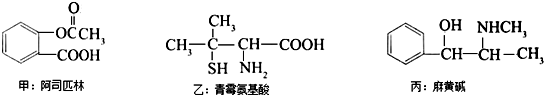
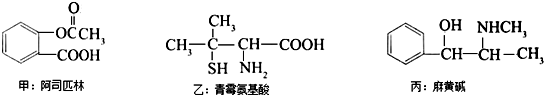
| A、都能发生酯化反应 |
| B、都能与NaOH反应 |
| C、甲的苯环上的一氯代物有4种 |
| D、丙的分子式为C10H15ON,苯环上的一氯代物有3种 |
在1100℃,一定容积的密闭容器中发生反应:X(s)+Y(g)═Q(s)+P(g)△H=+a kJ/mol(a>0),该温度下K=0.203,下列有关该反应的说法正确的是( )
| A、若生成1 molP(g),则放出的热量等于a kJ |
| B、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C、若升高温度,正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| D、达到化学平衡状态时,若c(Y)=0.100mol/L,则c(P)=0.0203 mol/L |
化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| D、青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是( )
| A、便于运输、储存,从安全角度考虑,硅是最佳的燃料 |
| B、自然界的含硅化合物易开采 |
| C、硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制 |
| D、自然界中存在大量单质硅 |