题目内容
关于如图所示的原电池,下列说法正确的是 ( )


| A、锌棒为正极 |
| B、铜棒上发生还原反应 |
| C、正极反应为Cu-2e-=Cu2+ |
| D、电流从锌棒经外电路流向铜棒 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池中,活泼金属作负极,负极发生氧化反应,正极发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极.
解答:
解:A、锌棒为负极,故A错误;
B、铜棒为正极,正极发生还原反应,故B正确;
C、正极反应式为2H++2e-=H2↑,故C错误;
D、电流从正极Cu经外电路流向Zn,故D错误;
故选B.
B、铜棒为正极,正极发生还原反应,故B正确;
C、正极反应式为2H++2e-=H2↑,故C错误;
D、电流从正极Cu经外电路流向Zn,故D错误;
故选B.
点评:本题考查原电池,利用氧化还原反应来分析电极反应是解答本题的关键,并熟悉工作原理来解答,难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列说法不正确的是( )
| A、油脂属于酯类 |
| B、油脂的氢化又叫油脂的硬化 |
| C、淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 |
| D、葡萄糖能发生银镜反应 |
下列事实能说明醋酸属于弱电解质的是( )
①中和10ml1mol/LCH3COOH溶液需要10ml1mol/LNaOH溶液
②物质的量溶液相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快
③0.01mol/L醋酸溶液pH的大于2
④0.1mol/LCH3COONa溶液显碱性.
①中和10ml1mol/LCH3COOH溶液需要10ml1mol/LNaOH溶液
②物质的量溶液相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快
③0.01mol/L醋酸溶液pH的大于2
④0.1mol/LCH3COONa溶液显碱性.
| A、①②③ | B、②③④ |
| C、①③④ | D、①④ |
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
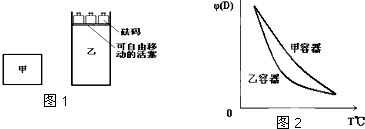

| A、甲容器中的反应先达到化学平衡状态 |
| B、两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C、两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D、在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
| A、液溴和苯分别受热变为气体 |
| B、干冰和氯化铵分别受热变为气体 |
| C、二氧化硅和铁分别受热熔化 |
| D、食盐和葡萄糖分别溶解在水中 |
下列描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ?mol-1 |
| C、牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀 |
| D、用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515.20.2g该样品与100mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为( )
| A、78 | B、140 |
| C、156 | D、172 |
 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是( )| A、用KI淀粉试纸和食醋无法检验加碘盐中是否含有碘 |
| B、足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O→2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>IO3->I2 |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |