题目内容
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10).
(1)滴定时应选用 作指示剂;
(2)判断到达滴定终点的实验现象是 .
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表:
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 %.(小数点后保留两位数字)
(5)若某样品可能由NaOH、Na2CO3、NaHCO3中的一种或两种组成,为确定其组成,某同学进行下列实验:
准确称取mg样品配制成250mL溶液,取配制好的溶液20.00mL于锥形瓶中,加入2滴酚酞作指示剂,用浓度为cmol?L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v1ml,然后再滴加2滴甲基橙继续用浓度为cmol?L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v2ml(v1和v2均不为0),
根据v1和v2数值大小判断样品的组成(用化学式表示):
①v1>v2
②v1=v2
③v1<v2.
(1)滴定时应选用
(2)判断到达滴定终点的实验现象是
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol?L-1的盐酸标准液进行滴定,相关数据记录如表:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.80 | 21.00 |
| 2 | 20.00 | 1.00 | 20.80 |
| 3 | 20.00 | 0.20 | 22.80 |
(5)若某样品可能由NaOH、Na2CO3、NaHCO3中的一种或两种组成,为确定其组成,某同学进行下列实验:
准确称取mg样品配制成250mL溶液,取配制好的溶液20.00mL于锥形瓶中,加入2滴酚酞作指示剂,用浓度为cmol?L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v1ml,然后再滴加2滴甲基橙继续用浓度为cmol?L-1的盐酸标准液进行滴定至终点,消耗盐酸标准液v2ml(v1和v2均不为0),
根据v1和v2数值大小判断样品的组成(用化学式表示):
①v1>v2
②v1=v2
③v1<v2.
考点:中和滴定
专题:实验题
分析:(1)根据酸碱指示剂变色的pH范围分析:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10,选择合适的指示剂,注意不能让碳酸钡与盐酸反应;
(2)根据滴定前溶液为红色,滴定结束时溶液为无色判断滴定终点现象;
(3)根据c(待测)=
分析滴定操作对测定结果的影响;
(4)根据表中实验3的初读数和末读数计算出消耗标准液盐酸的体积;根据三次滴定消耗的盐酸体积,先判断数据的有效性,然后计算出消耗盐酸的平均体积,再根据反应计算出待测液氢氧化钠的浓度及样品中NaOH的质量分数;
(5)酚酞作指示剂时NaHCO3不会被滴定,若用酚酞作指示剂,则滴定终点时:NaOH→NaCl,Na2CO3→NaHCO3;后加甲基橙(在pH小于3.1时显红色,pH为3.1~4.4时呈橙色,pH大于4.4时呈黄色)作指示剂,指示反应为:NaHCO3+HCl═NaCl+CO2↑+H2O;
根据两步反应需要盐酸的体积确定物质(v1和v2均不为0),在溶液中NaOH与NaHCO3不能共存,如果是纯碳酸钠溶液,则与盐酸反应两次消耗的盐酸由反应方程式可知其物质的量相等,即V1=V2,若V1>V2,固体中必定含有氢氧化钠,因为盐酸加进去先跟氢氧化钠反应,后跟碳酸钠反应,为NaOH、Na2CO3.
(2)根据滴定前溶液为红色,滴定结束时溶液为无色判断滴定终点现象;
(3)根据c(待测)=
| c(标准)?V(标准) |
| c(待测) |
(4)根据表中实验3的初读数和末读数计算出消耗标准液盐酸的体积;根据三次滴定消耗的盐酸体积,先判断数据的有效性,然后计算出消耗盐酸的平均体积,再根据反应计算出待测液氢氧化钠的浓度及样品中NaOH的质量分数;
(5)酚酞作指示剂时NaHCO3不会被滴定,若用酚酞作指示剂,则滴定终点时:NaOH→NaCl,Na2CO3→NaHCO3;后加甲基橙(在pH小于3.1时显红色,pH为3.1~4.4时呈橙色,pH大于4.4时呈黄色)作指示剂,指示反应为:NaHCO3+HCl═NaCl+CO2↑+H2O;
根据两步反应需要盐酸的体积确定物质(v1和v2均不为0),在溶液中NaOH与NaHCO3不能共存,如果是纯碳酸钠溶液,则与盐酸反应两次消耗的盐酸由反应方程式可知其物质的量相等,即V1=V2,若V1>V2,固体中必定含有氢氧化钠,因为盐酸加进去先跟氢氧化钠反应,后跟碳酸钠反应,为NaOH、Na2CO3.
解答:
解:(1)根据题中提供的酸碱指示剂的变色范围可知,只有酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应,
故答案为:酚酞;
(2)原溶液为碱性,酚酞为红色,滴定终点时,红与粉红无明显变化,故非终点,终点应为粉红色变为无色,所以达到终点的现象为:溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点,
故答案为:溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点;
(3)A.锥形瓶用蒸馏水洗后未用待测液润洗,对待测液物质的量没有影响,不影响滴定结果,故A错误;
B.酸式滴定管用蒸馏水洗后未用标准液润洗,导致标准液浓度减小,滴定时消耗的标准液体积偏大,根据c(待测)=
可知,测定结果偏高,故B正确;
C.在滴定前有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,根据c(待测)=
可知,测定结果偏高,故C正确;
D.滴定前平视读数,滴定结束俯视读数,导致读出的标准液体积偏小,根据c(待测)=
可知,测定结果偏低,故D错误;
故选BC;
(4)实验1、2、3的到达滴定终点时所耗HCl溶液的分别体积为:20.20mL,19.80mL,22.60mL,所以第三次滴定为无效数据,消耗盐酸的平均体积为:
=20.00mL,待测液氢氧化钠的浓度为:c(待测)=
=
=0.2mol/L,
5.0g样品配制成的250mL溶液中含有的氢氧化钠的物质的量为:0.2mol/L×250×10-3L=0.05mol,
样品中氢氧化钠的质量分数为:ω(NaOH)=
×100%=40%,
故答案为:40.00;
(5)酚酞在pH大于10时显红色,pH为8~10时显浅红色,在pH小于7时褪为无色,以酚酞作指示剂,指示反应为NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3;
后加甲基橙(在pH小于3.1时显红色,pH为3.1~4.4时呈橙色,pH大于4.4时呈黄色)作指示剂,指示反应为:NaHCO3+HCl═NaCl+CO2↑+H2O;
当固体为NaOH和Na2CO3,第一步发生的反应为NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3,第二步发生的反应为NaHCO3+HCl═NaCl+CO2↑+H2O,碳酸钠第一步、第二步和盐酸反应需要体积相等,则第一步多出的盐酸和氢氧化钠反应,则v1>v2,
当固体为Na2CO3,第一步发生的反应为Na2CO3+HCl═NaCl+NaHCO3,第二步发生的反应为NaHCO3+HCl═NaCl+CO2↑+H2O,碳酸钠第一步、第二步和盐酸反应需要体积相等,则v1=v2,
在溶液中NaOH与NaHCO3不能共存,当固体为Na2CO3、NaHCO3,第一步发生的反应为Na2CO3+HCl═NaCl+NaHCO3,第二步发生的反应为NaHCO3+HCl═NaCl+CO2↑+H2O,第二步和盐酸反应需要体积大于第一步,则v1<v2,
故答案为:①NaOH、Na2CO3;②Na2CO3;③Na2CO3、NaHCO3.
故答案为:酚酞;
(2)原溶液为碱性,酚酞为红色,滴定终点时,红与粉红无明显变化,故非终点,终点应为粉红色变为无色,所以达到终点的现象为:溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点,
故答案为:溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点;
(3)A.锥形瓶用蒸馏水洗后未用待测液润洗,对待测液物质的量没有影响,不影响滴定结果,故A错误;
B.酸式滴定管用蒸馏水洗后未用标准液润洗,导致标准液浓度减小,滴定时消耗的标准液体积偏大,根据c(待测)=
| c(标准)?V(标准) |
| c(待测) |
C.在滴定前有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,根据c(待测)=
| c(标准)?V(标准) |
| c(待测) |
D.滴定前平视读数,滴定结束俯视读数,导致读出的标准液体积偏小,根据c(待测)=
| c(标准)?V(标准) |
| c(待测) |
故选BC;
(4)实验1、2、3的到达滴定终点时所耗HCl溶液的分别体积为:20.20mL,19.80mL,22.60mL,所以第三次滴定为无效数据,消耗盐酸的平均体积为:
| 20.20mL+19.80mL |
| 2 |
| c(标准)?V(标准) |
| c(待测) |
| 20×10-3L×0.2mol/L |
| 20×10-3L |
5.0g样品配制成的250mL溶液中含有的氢氧化钠的物质的量为:0.2mol/L×250×10-3L=0.05mol,
样品中氢氧化钠的质量分数为:ω(NaOH)=
| 0.05mol×40g/mol |
| 5g |
故答案为:40.00;
(5)酚酞在pH大于10时显红色,pH为8~10时显浅红色,在pH小于7时褪为无色,以酚酞作指示剂,指示反应为NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3;
后加甲基橙(在pH小于3.1时显红色,pH为3.1~4.4时呈橙色,pH大于4.4时呈黄色)作指示剂,指示反应为:NaHCO3+HCl═NaCl+CO2↑+H2O;
当固体为NaOH和Na2CO3,第一步发生的反应为NaOH+HCl═NaCl+H2O、Na2CO3+HCl═NaCl+NaHCO3,第二步发生的反应为NaHCO3+HCl═NaCl+CO2↑+H2O,碳酸钠第一步、第二步和盐酸反应需要体积相等,则第一步多出的盐酸和氢氧化钠反应,则v1>v2,
当固体为Na2CO3,第一步发生的反应为Na2CO3+HCl═NaCl+NaHCO3,第二步发生的反应为NaHCO3+HCl═NaCl+CO2↑+H2O,碳酸钠第一步、第二步和盐酸反应需要体积相等,则v1=v2,
在溶液中NaOH与NaHCO3不能共存,当固体为Na2CO3、NaHCO3,第一步发生的反应为Na2CO3+HCl═NaCl+NaHCO3,第二步发生的反应为NaHCO3+HCl═NaCl+CO2↑+H2O,第二步和盐酸反应需要体积大于第一步,则v1<v2,
故答案为:①NaOH、Na2CO3;②Na2CO3;③Na2CO3、NaHCO3.
点评:本题考查了酸碱中和实验的有关判断、误差分析,探究物质的组成,该题是中等难度的试题,试题综合性强,注重能力的培养.该题的难点在于误差分析,误差分析的总依据为:c(待测)=
,c(待测)的大小取决于V(标准)的大小,注意根据两步反应需要盐酸体积的大小确定溶液中的溶质.
| c(标准)?V(标准) |
| c(待测) |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏加德罗常数.下列叙述正确的是( )
| A、1.0 L 0.1 mol/L的NH4Cl溶液中NH4+的数目为0.1NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA |
| C、常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
| D、高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
高温下,某反应达平衡,平衡常数K=
.恒容时,温度升高,B的浓度减小.下列说法正确的是( )
①该反应的焓变为正值
②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小
④该反应化学方程式为C(g)+D(g)?A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动
⑥加入催化剂,B的转化率提高.
| c(C)c(D) |
| c(A)c(B) |
①该反应的焓变为正值
②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小
④该反应化学方程式为C(g)+D(g)?A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动
⑥加入催化剂,B的转化率提高.
| A、①③⑥ | B、①⑤ |
| C、①④⑤ | D、②⑤ |
下列实验操作或装置不符合实验要求的是( )
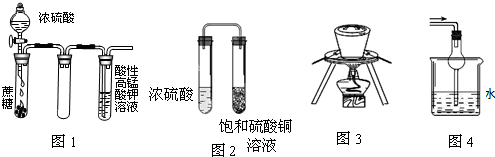

| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
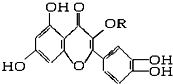

| A、可与溴水反应,且1 mol该物质与足量溴水反应耗6 mol Br2 |
| B、可与NaOH溶液反应,1 mol该物质可与4 mol NaOH反应 |
| C、一定条件下1 mol该物质可与H2加成,耗H2最大量为7 mol |
| D、维生素P遇FeCl3溶液发生显色反应 |
 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.