题目内容
4.已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸.物质之间的转化关系如图1所示(图中部分反应物或生成物及反应条件未列出).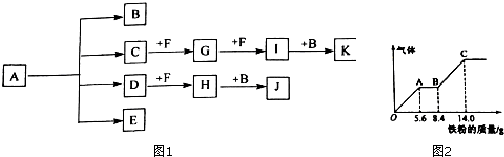
请回答下列问题:
(1)C、E分别是NH3、N2.
(2)写出A强热分解生成B、C、D、E的化学方程式3(NH4)2SO4$\frac{\underline{\;强热\;}}{\;}$3SO2↑+4NH3↑+N2↑+6H2O.
(3)写出D通人FeCl 3 溶液时,发生反应的离子方程式SO2+2Fe3++2H2O=SO42-+2Fe2++4H+.
(4)-定浓度J、K混合后的稀溶液200mL,平均分成两份.向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G).向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图2所示.则①a=9.6g,②生成的气体G标准状况下体积为2.24L,③J的物质的量浓度为2.5mol/L.
分析 正盐A强热可得到B、C、D、E四种物质,D能产生酸雨,I为红棕色气体,则D为SO2,I为NO2,E、F 是空气主要成分,分别为N2、O2中的一种,C能与F连续反应得到NO2,可推知F为O2、C为NH3、G为NO,故E为N2.J、K为两种常见的酸,B通常情况下为无色无味液体,酸K可以由B与NO2反应得到,则B为H2O、K为HNO3.SO2与氧气反应生成H为SO3,进一步与水化合生成J为H2SO4,C(NH3)与J反应可得A,且为正盐,故A为(NH4)2SO4,据此解答.
解答 解:正盐A强热可得到B、C、D、E四种物质,D能产生酸雨,I为红棕色气体,则D为SO2,I为NO2,E、F 是空气主要成分,分别为N2、O2中的一种,C能与F连续反应得到NO2,可推知F为O2、C为NH3、G为NO,故E为N2.J、K为两种常见的酸,B通常情况下为无色无味液体,酸K可以由B与NO2反应得到,则B为H2O、K为HNO3.SO2与氧气反应生成H为SO3,进一步与水化合生成J为H2SO4,C(NH3)与J反应可得A,且为正盐,故A为(NH4)2SO4,
(1)由上述分析可知,C为NH3,E为N2,
故答案为:NH3;N2;
(2)A为(NH4)2SO4,A强热分解生成B、C、D、E的化学方程式为:3(NH4)2SO4$\frac{\underline{\;强热\;}}{\;}$3SO2↑+4NH3↑+N2↑+6H2O,
故答案为:3(NH4)2SO4$\frac{\underline{\;强热\;}}{\;}$3SO2↑+4NH3↑+N2↑+6H2O;
(3)SO2通入FeCl3溶液时,被氧化生成硫酸根,同时铁离子被还有为亚铁离子,反应的离子方程式为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
(4)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,
Cu与混酸反应生成NO,反应生成NO物质的量等于Fe反应生成NO的物质的量,OA段发生反应生成NO,该阶段消耗Fe为5.6g,其物质的量=$\frac{5.6g}{56g/mol}$=0.1mol,由方程式可知,生成NO为0.1mol,根据电子转移守恒可知,参加反应的Cu的物质的量=$\frac{0.1mol×(5-2)}{2}$=0.15mol,故可以溶解Cu的质量=0.15mol×64g/mol=9.6g,
故反应生成NO的体积=0.1mol×22.4L/mol=2.24L;
反应消耗14g铁,其物质的量=$\frac{14g}{56g/mol}$=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.25mol,所以硫酸的浓度=$\frac{0.25mol}{0.1L}$=2.5mol/L,
故答案为:9.6;2.24L;2.5mol/L.
点评 本题考查无机物推断、化学计算等,充分利用题目给予的信息,对学生的逻辑推理有一定的要求,(4)中关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,难度较大.

| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-═NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O═2Mn2++5O2↑+8H2O |
①Fe:12;②Fe3O4:28;③Fe(OH)2:10;④FeSO3:4.
| A. | 只有①② | B. | 只有③④ | C. | 只有①②③ | D. | ①②③④ |
①电解池是将化学能转变成电能的装置,原电池是将电能转变成化学能的装置
②需要通电后才可以发生或进行的有:电离、电泳、电解、电镀、电化学腐蚀
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化.
| A. | ①②③④ | B. | ③④⑤ | C. | ③④ | D. | ④ |
| A. | a2<a3<a1<a4 | B. | a3=a2<a1<a4 | C. | a2=a3<a4<a1 | D. | a1<a2<a3<a4 |
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为NA | |
| C. | 1mol碳正离子CH5+所含的电子数为10NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |


 .
.