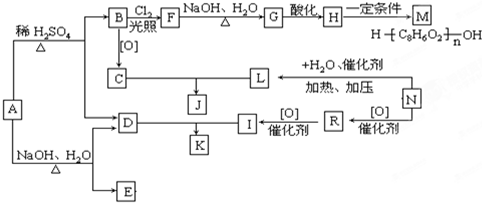
题目内容
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol/L与Bmol/L,则A和B关系为( )
| A、A=B |
| B、A=10-4 B |
| C、B=10-4 A |
| D、无法确定 |
考点:pH的简单计算,盐类水解的应用
专题:
分析:酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=9的氢氧化钠和醋酸钠,醋酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+),醋酸钠溶液中水电离出的c(OH-)=
.
| KW |
| c(H+) |
解答:
解:酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=9的氢氧化钠和醋酸钠,醋酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+)=10-9 mol/L,醋酸钠溶液中水电离出的c(OH-)=
=
mol/L=10-5 mol/L,所以A=10-4B,
故选B.
| KW |
| c(H+) |
| 10-14 |
| 10-9 |
故选B.
点评:本题考查了水的电离,明确哪些物质促进水电离、哪些物质抑制水电离是解本题关键,注意酸溶液中水电离出氢离子浓度、碱溶液中水电离出氢氧根离子浓度的计算方法,为易错点.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
若在滴定操作中,选用已知浓度的KMnO4溶液测定未知浓度的硫酸亚铁的浓度,高锰酸钾应装入( )
| A、酸式滴定管 |
| B、碱式滴定管 |
| C、酸式、碱式滴定管都可以 |
| D、只能装入锥形瓶,不能装入滴定管中 |
在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法中,正确的是( )
| A、溶液中的各离子浓度一定存在下列关系:c(Na+)<2 c(CO32-)+c(HCO3-) |
| B、通入CO2,平衡向正反应方向移动 |
| C、稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D、加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |