题目内容
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中.钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液.
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: .
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”).
(3)在步骤③中,需要 1.00mol?L-1氢氧化钠标准溶液450mL,配制该溶液需用托盘天平称取 gNaOH固体.
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液.
(1)上述步骤②中的水解反应方程式为
步骤③中反应的离子方程式为:
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(3)在步骤③中,需要 1.00mol?L-1氢氧化钠标准溶液450mL,配制该溶液需用托盘天平称取
考点:中和滴定
专题:
分析:(1)氟硅酸钾(K2SiF6)沉淀于热水中水解,生成HF、H2SiO3、KF,结合原子守恒书写化学方程式;步骤③中反应是过滤除去硅酸沉淀后用氢氧化钠溶液滴定生成的HF溶液,发生的反应书写离子方程式;
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大;
(3)没有450mL容量瓶,故需配制500mL1.00mol/L的氢氧化钠,根据m=cVM计算.
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大;
(3)没有450mL容量瓶,故需配制500mL1.00mol/L的氢氧化钠,根据m=cVM计算.
解答:
解:(1)氟硅酸钾(K2SiF6)沉淀于热水中水解,生成HF、H2SiO3、KF,结合原子守恒书写化学方程式,反应的化学方程式为:K2SiF6+3H2O=2KF+H2SiO3+4HF;步骤③中反应是过滤除去硅酸沉淀后用氢氧化钠溶液滴定生成的HF溶液,反应的离子方程式 HF+OH-=F-+H2O,
故答案为:K2SiF6+3H2O=2KF+H2SiO3+4HF;HF+OH-=F-+H2O;
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大,结果偏高,
故答案为:偏高;
(3)没有450mL容量瓶,故需配制500mL1.00mol/L的氢氧化钠,m=1.00mol/L×0.5L×40g/mol=20.0g,故答案为:20.0g.
故答案为:K2SiF6+3H2O=2KF+H2SiO3+4HF;HF+OH-=F-+H2O;
(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,滴定过程中消耗的氢氧化钠溶液体积增大,计算反应的HF量增大,测定的硅元素含量会增大,结果偏高,
故答案为:偏高;
(3)没有450mL容量瓶,故需配制500mL1.00mol/L的氢氧化钠,m=1.00mol/L×0.5L×40g/mol=20.0g,故答案为:20.0g.
点评:本题考查了化学方程式和离子方程式书写方法,滴定实验过程的分析及一定物质的量浓度的配制及误差分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
室温下,由水电离出的c(OH-)=1×10-13mol的溶液中,一定能够大量共存的离子组是( )
| A、K+、A13+、HCO3-、SO42- |
| B、Na+、I-、SO32-、NO3- |
| C、NH4+、Fe2+、ClO-、C1- |
| D、K+、Na+、SO42-、NO3- |
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol/L与Bmol/L,则A和B关系为( )
| A、A=B |
| B、A=10-4 B |
| C、B=10-4 A |
| D、无法确定 |
已知2mol氢气燃烧生成水蒸气时,放出484kJ热量.下列热化学方程式正确的是( )
| A、2H2(g)+O2(g)=2H2O(g)△H=+484kJ?mol-1 | ||
| B、2H2(g)+O2(g)=2H2O(l)△H=-484kJ?mol-1 | ||
C、H2(g)+
| ||
D、H2(g)+
|
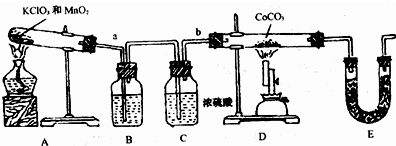
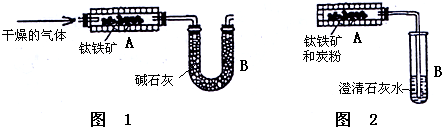
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题: