题目内容
(1)某化学兴趣小组要完成反应热的测定.实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌器、0.50mol?L-1 盐酸、0.50mol?L-1NaOH溶液,实验尚缺少的玻璃用品是 、 .
(2)已知2molCO气体完全燃烧生成CO2气体放出566kJ热量;1mol氢气完全燃烧生成液态水放出286kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量.写出用标准燃烧热作为反应热的CO燃烧的热化学方程式 .若1molCH4气体完全燃烧生成CO2固体和液态水,放出热量 890kJ( 填“>”、“<”、“=”).若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是 .
(2)已知2molCO气体完全燃烧生成CO2气体放出566kJ热量;1mol氢气完全燃烧生成液态水放出286kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量.写出用标准燃烧热作为反应热的CO燃烧的热化学方程式
考点:用盖斯定律进行有关反应热的计算,中和热的测定
专题:
分析:(1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)依据热化学方程式书写方法写出热化学方程式,标注物质聚集状态和对应焓变;
根据不同聚集状态的水的能量不同,进行判断1mol CH4气体完全燃烧生成CO2气体和水蒸气放出的热量;
根据CO2气体和液态水的物质的量相等,利用讨论法计算.
(2)依据热化学方程式书写方法写出热化学方程式,标注物质聚集状态和对应焓变;
根据不同聚集状态的水的能量不同,进行判断1mol CH4气体完全燃烧生成CO2气体和水蒸气放出的热量;
根据CO2气体和液态水的物质的量相等,利用讨论法计算.
解答:
解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒;
故答案为:量筒;温度计.
(2)2molCO气体完全燃烧生成CO2气体放出566kJ热量,则1molCO气体完全燃烧生成CO2气体放出283kJ热量,
表示CO燃烧热的化学方程式为:CO(g)+
O2(g)=CO2(l)△H=-283kJ?mol-1,
二氧化碳由气态变为固态时要放出热量,由于1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,则1mol CH4气体完全燃烧生成CO2固体和液态水,放出的热量大于890kJ,
生成的CO2和液态水的物质的量相等,用假设分析,有以下几种可能:
①若无CO,生成的CO2和液态水的物质的量不相等,故不合题意;
②若无H2,可能是CO和CH4各为
mol,生成液态水放出的热量(Q)=
(283+890)=586.5aKJ;
③若无CH4,可能是CO和H2各为
mol,生成液态水放出的热量(Q)=
×(283+286)=284.5akJ;
④若无两种气体均不可能,
所以放出的热量(Q)的取值范围为:284.5aKJ<Q<586.5aKJ,
故答案为:CO(g)+
O2(g)=CO2(l)△H=-283kJ?mol-1;>;284.5a KJ<Q<586.5aKJ.
故答案为:量筒;温度计.
(2)2molCO气体完全燃烧生成CO2气体放出566kJ热量,则1molCO气体完全燃烧生成CO2气体放出283kJ热量,
表示CO燃烧热的化学方程式为:CO(g)+
| 1 |
| 2 |
二氧化碳由气态变为固态时要放出热量,由于1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,则1mol CH4气体完全燃烧生成CO2固体和液态水,放出的热量大于890kJ,
生成的CO2和液态水的物质的量相等,用假设分析,有以下几种可能:
①若无CO,生成的CO2和液态水的物质的量不相等,故不合题意;
②若无H2,可能是CO和CH4各为
| a |
| 2 |
| a |
| 2 |
③若无CH4,可能是CO和H2各为
| a |
| 2 |
| a |
| 2 |
④若无两种气体均不可能,
所以放出的热量(Q)的取值范围为:284.5aKJ<Q<586.5aKJ,
故答案为:CO(g)+
| 1 |
| 2 |
点评:本题考查中和热的测定、热化学方程式的书写、有关反应热的简单计算,题目难度中等,注意掌握热化学方程式的书写原则,能够根据物质的状态判断对反应热的影响.注意极限法和讨论法的计算运用.

练习册系列答案
相关题目
下列实验设计及其对应的离子方程式均正确的是( )
| A、Cl2通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O | ||
| B、用盐酸酸化的BaCl2溶液,证明某未知溶液中含有SO42-:Ba2++SO42-=BaSO4↓ | ||
| C、用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | ||
D、用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]+
|
一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:A(g)+3B(g)?2C(g)经2分钟反应达到平衡,此时生成0.2mol C.下列说法正确的是( )
| A、反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L?min) |
| B、反应开始至2分钟时,A的转化率为10% |
| C、若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0 |
D、若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图 |
根据表中数据,下列判断正确的是( )
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
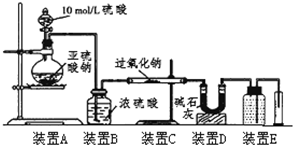 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.