题目内容
13. 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
(1)生成PCl3的反应是放热反应(填吸热反应或放热反应),生成2molPCl3时,焓变为-612KJ/mol,写出该反应的热化学方程式P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1.
(2)PCl5分解成PCl3和Cl2时,该反应为吸热反应(填吸热反应或放热反应),该反应的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(3)P和Cl2分两步反应生成1molPCl5的△H3=-399kJ•mol-1,P和Cl2一步反应生成1molPCl5的△H4等于△H3(填“大于”、“小于”或“等于”).
分析 根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用.
解答 解:(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306KJ的能量,生成2molPCl3时,焓变为-612KJ/mol;则反应的热化学方程式为P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1,
故答案为:放热反应;-612KJ/mol;P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1,
故答案为:吸热反应;PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(3)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
故答案为:-399kJ•mol-1;等于.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
4.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 反应进行30s时,正反应速率等于逆反应速率 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 前60 s,以X浓度变化表示的平均反应速率为0.0005mol/(L•s) | |
| D. | 反应进行80s时,X物质的量浓度为0.04mol/L |
1. 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如表所示:
(1)步骤一所用仪器已有托盘天平(带砝码)、玻璃棒、烧杯、药匙,还缺少的仪器250mL容量瓶、胶头滴管.
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如表所示:
| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 见右图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
2.下列各式表示水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | Br-+H2O?HBr+OH- |
3. 用如图所示装置检验生成气体时,不能达到目的是( )
用如图所示装置检验生成气体时,不能达到目的是( )
 用如图所示装置检验生成气体时,不能达到目的是( )
用如图所示装置检验生成气体时,不能达到目的是( )| 选项 | 生成的气体 | 试剂X | 试剂Y |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | 溴水 |
| B | 木炭与浓H2SO4加热得到的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH醇溶液共热得 到的乙烯 | 水 | KMnO4 酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | 溴水 |
| A. | A | B. | B | C. | C | D. | D |
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.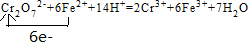 .
. A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:
A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系: