题目内容
4.下列表示反应2A+B=C+D的速率最快的是( )| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
分析 不同物质的反应速率之比等于其化学计量数之比,则不同物质的化学反应速率与其化学计量数的比值越大,反应速率越快,注意保持单位一致.
解答 解:解:不同物质的反应速率之比等于其化学计量数之比,则不同物质的化学反应速率与其化学计量数的比值越大,反应速率越快.
A.$\frac{v(A)}{2}$=0.25mol.L-1.s-1;
B.$\frac{v(D)}{1}$=0.2mol.L-1.s-1;
C.$\frac{v(C)}{1}$=0.25mol.L-1.S-1;
D.$\frac{v(B)}{1}$=0.3mol.L-1.s-1;
故选:D.
点评 本题考查化学反应速率快慢比较,可以将不同物质转化为同一物质的反应速率进行比较,注意单位要统一.

练习册系列答案
相关题目
15.下列反应不属于加成反应的是( )
| A. | CH≡CH+2Br2→CHBr2-CHBr2 | B. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | ||
| C. |  +HCN$\stackrel{催化剂}{→}$ +HCN$\stackrel{催化剂}{→}$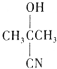 | D. | CH3COOH+NH3$\stackrel{△}{→}$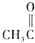 -NH2+H20 -NH2+H20 |
19.下列有关碱金属的说法不正确的是( )
| A. | 均为ⅠA族元素,最外层均有1个电子 | |
| B. | 单质的还原性:Li>Na>K>Rb>Cs | |
| C. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| D. | 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大 |
9.关于如图的说法不正确的是( )
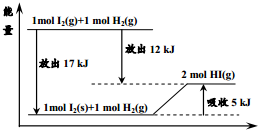

| A. | 1mol固态碘与1molH2化合生成2molHI气体时,需要吸收5kJ的能量 | |
| B. | 2molHI气体分解生成1mol碘蒸气与1molH2时需要吸收12kJ的能量 | |
| C. | 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量 | |
| D. | 碘蒸气与H2生成HI气体的反应是吸热反应 |
16.下列有关氧元素及其化合物表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 氧原子的结构示意图: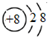 | |
| C. | 过氧化氢的电子式: | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
13.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 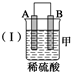 | 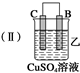 |  |
| 现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu,溶液中Cu2+向C极移动(填“B”或“C”).
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为0.3NA.
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
14.下列说法正确的是( )
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |