题目内容
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )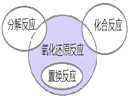

| A、4NH3+5O2═4NO+6H2O |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| C、2NaHCO3═Na2CO3+H2O+CO2↑ |
| D、Cl2+2NaBr═2NaCl+Br2 |
考点:氧化还原反应,化学基本反应类型
专题:氧化还原反应专题
分析:由图中阴影位置可知,属于氧化还原反应,但不是置换反应、化合反应、分解反应,结合元素的化合价变化及基本反应类型的概念来解答.
解答:
解:A.N、O元素的化合价变化,为氧化还原反应,但生成物没有单质,不属于置换反应,反应物有2种,不属于分解反应,生成物有2种,不属于化合反应,故A选;
B.Fe、O元素的化合价变化,为氧化还原反应,但为化合反应,故B不选;
C.没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.Cl、Br元素的化合价变化,为氧化还原反应,但属于置换反应,故D不选;
故选A.
B.Fe、O元素的化合价变化,为氧化还原反应,但为化合反应,故B不选;
C.没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.Cl、Br元素的化合价变化,为氧化还原反应,但属于置换反应,故D不选;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化是解答本题的关键,注意基本反应类型及氧化还原反应判断方法,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A、反应中KMnO4被氧化 |
| B、氧化产物与还原产物的物质的量之比为2:5 |
| C、每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D、每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |
通常把原子总数和价电子总数相同的分子或离子称为等电子体.等电子体具有相似的化学结构,则下列有关说法中正确的是( )
| A、CH4和NH4+是等电子体,化学键类型完全相同 |
| B、NO3-和CO32-是等电子体,均为平面正三角形结构 |
| C、H3O+和PCl3是等电子体,均为三角锥形结构 |
| D、SO2和O3是等电子体,SO2和O3具有相同的化学性质 |
下列离子方程式书写正确的是( )
| A、给与水的反应:Na+H2O=Na++OH-+H2↑ |
| B、氯化铝溶液中满加过量氯水:Al3++4NH3?H2O=[Al(OH)4]++4NH4+ |
| C、硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
| D、AgCl悬浊液中滴加KI,现现黄色沉淀:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq) |
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温常压下,28g氮气所含有的原子数目为NA |
| B、1molNa被完全氧化生成Na2O2,失去电子数目为NA |
| C、标准状况下,22.4L水中含有NA个水分子 |
| D、56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
分子式为C9H12的芳香烃,其可能的结构有( )
| A、5种 | B、6种 | C、7种 | D、8种 |
