题目内容
氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4对空气和水都不稳定.但将粉末状的Si3N4和适量氧化镁在230×1.01×105 Pa和185℃的密闭容器中热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到对水不稳定的Mg3N2.
(1)写出由SiCl4和NH3反应制取Si3N4的化学反应方程式: .
(2)Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理的过程中,除生成Mg3N2外,还可能生成 .热处理后除去MgO和Mg3N2的方法是 .
(1)写出由SiCl4和NH3反应制取Si3N4的化学反应方程式:
(2)Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中热处理的过程中,除生成Mg3N2外,还可能生成
考点:含硅矿物及材料的应用
专题:碳族元素
分析:(1)根据反应物和生成物写出化学方程式;
(2)Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质.
(2)Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质.
解答:
解:(1)SiCl4和NH3反应生成Si3N4和氯化氢,反应化学反应方程式:3SiCl4+4NH3═Si3N4+12HCl,故答案为:3SiCl4+4NH3═Si3N4+12HCl;
(2)由元素守恒判断,Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,利用SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质,可采用加入足量稀盐酸的方法,使MgO、Mg3N2溶解后过滤,故答案为:SiO2(或MgSiO3);加足量稀盐酸,过滤.
(2)由元素守恒判断,Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,利用SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质,可采用加入足量稀盐酸的方法,使MgO、Mg3N2溶解后过滤,故答案为:SiO2(或MgSiO3);加足量稀盐酸,过滤.
点评:本题考查硅和二氧化硅的性质,题目难度较大,注意根据质量守恒书写化学方程式.

练习册系列答案
相关题目
要使氯化铝中的Al3+完全转化为氢氧化铝沉淀,应选用的最佳试剂是( )
| A、硫酸 | B、氨水 |
| C、盐酸 | D、氢氧化钠 |
制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得.下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
| A、CuCl2 |
| B、FeCl3 |
| C、AlCl3 |
| D、FeCl2 |
在2A+B=3C+4D的反应中,下列表示该反应速率最大的是( )
| A、v(A)=0.8mol/(L?S) |
| B、v(B)=0.3mol/(L?S) |
| C、v(C)=0.5mol/(L?S) |
| D、v(D)=60mol/(L?min) |
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )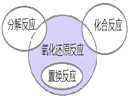

| A、4NH3+5O2═4NO+6H2O |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| C、2NaHCO3═Na2CO3+H2O+CO2↑ |
| D、Cl2+2NaBr═2NaCl+Br2 |
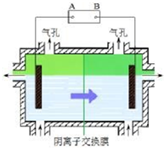 某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: