题目内容
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A、反应中KMnO4被氧化 |
| B、氧化产物与还原产物的物质的量之比为2:5 |
| C、每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D、每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答:
解:A.Mn元素的化合价降低,得到电子KMnO4被还原,故A错误;
B.氧化产物为Cl2,还原产物为MnCl2,由反应可知氧化产物与还原产物的物质的量之比为5:2,故B错误;
C.每生成1 mol Cl2时,反应中转移的电子为1mol×2×[0-(-1)]=2 mol,故C正确;
D.每消耗16 mol HCl时,由反应可知,只有10molCl失去电子,则其中做还原剂的HCl是10 mol,故D错误;
故选C.
B.氧化产物为Cl2,还原产物为MnCl2,由反应可知氧化产物与还原产物的物质的量之比为5:2,故B错误;
C.每生成1 mol Cl2时,反应中转移的电子为1mol×2×[0-(-1)]=2 mol,故C正确;
D.每消耗16 mol HCl时,由反应可知,只有10molCl失去电子,则其中做还原剂的HCl是10 mol,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化是解答本题的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出(标准状况下)氢气22.4L,据此推断乙可能是( )
| A、CH3CHOHCHOHCH3 |
| B、HOCH2CHOHCH3 |
| C、CH3CH2CH2OH |
| D、CH3CHOHCH3 |
制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得.下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )
| A、CuCl2 |
| B、FeCl3 |
| C、AlCl3 |
| D、FeCl2 |
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )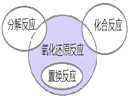

| A、4NH3+5O2═4NO+6H2O |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| C、2NaHCO3═Na2CO3+H2O+CO2↑ |
| D、Cl2+2NaBr═2NaCl+Br2 |
某原子核外电子排布式为ns2np7,它违背了( )
| A、泡利原理 |
| B、能量最低原理 |
| C、洪特规则 |
| D、洪特规则特例 |
家用管道煤气的主要成分是CO、H2、CH4,取1L管道煤气充分燃烧需要同温同压下的空气5L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能是( )
| A、1:1:1 |
| B、1:1:2 |
| C、2:4:3 |
| D、1:3:2 |
在容量瓶上,下列标记不存在的是( )
| A、标线 | B、温度 |
| C、浓度 | D、容量规格 |