题目内容
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温常压下,28g氮气所含有的原子数目为NA |
| B、1molNa被完全氧化生成Na2O2,失去电子数目为NA |
| C、标准状况下,22.4L水中含有NA个水分子 |
| D、56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氮气为双原子分子,28g氮气的物质的量为1mol,含有2mol氮原子;
B.钠为1价金属,1mol钠完全反应失去1mol电子;
C.标准状况下,水的状态不是气体,不能使用气体摩尔体积计算其物质的量;
D.铁的反应产物中化合价有+2、+3价,转移电子数需要根据反应产物中铁元素的化合价判断.
B.钠为1价金属,1mol钠完全反应失去1mol电子;
C.标准状况下,水的状态不是气体,不能使用气体摩尔体积计算其物质的量;
D.铁的反应产物中化合价有+2、+3价,转移电子数需要根据反应产物中铁元素的化合价判断.
解答:
解:A.28g氮气的物质的量为1mol,1mol氮气中含有2mol氮原子,所含有的原子数目为2NA,故A错误;
B.1mol钠完全反应生成过氧化钠,失去1mol电子,失去电子数目为NA,故B正确;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量,故C错误;
D.56g铁的物质的量为1mol,1mol铁与稀盐酸反应失去2mol电子,与氯气反应失去3mol电子,所以1mol铁完全反应时转移的电子数不一定为2NA,故D错误;
故选B.
B.1mol钠完全反应生成过氧化钠,失去1mol电子,失去电子数目为NA,故B正确;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量,故C错误;
D.56g铁的物质的量为1mol,1mol铁与稀盐酸反应失去2mol电子,与氯气反应失去3mol电子,所以1mol铁完全反应时转移的电子数不一定为2NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )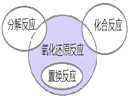

| A、4NH3+5O2═4NO+6H2O |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| C、2NaHCO3═Na2CO3+H2O+CO2↑ |
| D、Cl2+2NaBr═2NaCl+Br2 |
化学与生产、生活、社会密切相关.下列有关说法中,错误的是( )
| A、服用铬含量超标的药用胶囊,会对人体健康造成危害 |
| B、血液透析是利用了胶体的性质 |
| C、绿色化学的核心是应用化学原理对环境污染进行治理 |
| D、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
家用管道煤气的主要成分是CO、H2、CH4,取1L管道煤气充分燃烧需要同温同压下的空气5L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能是( )
| A、1:1:1 |
| B、1:1:2 |
| C、2:4:3 |
| D、1:3:2 |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、7 g CnH2n中含氢原子数为NA | ||||
| B、4.6 g SO2、CO2混合气体中含有中子数为2.3NA | ||||
C、在反应2Na2O2+2 CO2
| ||||
| D、电解精炼铜时每转移NA个电子,阳极溶解32 g铜 |
下列实验操作正确的是( )
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 |
| C、先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称量 |
| D、过滤时,慢慢地将液体直接倒入过滤器中 |

 如图所示:
如图所示: