题目内容
9.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| D. | 标准状况下2.7g Al与足量的该硫酸反应可得到H2 3.36L |
分析 该浓硫酸的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4molL,
A.浓硫酸变成稀硫酸后反应停止,则反应生成二氧化硫的物质的量减小,被还原的硫酸减少;
B.稀释浓硫酸时,应该将浓硫酸缓缓倒入水中,顺序不能颠倒;
C.根据分析可知该浓硫酸的物质的量浓度.
D.常温下铝与浓硫酸发生钝化现象.
解答 解:该浓硫酸的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4molL,
A.50 mL该H2SO4中还原硫酸的物质的量为:18.4mol/L×0.05L=0.92mol,由于随着反应的进行,浓硫酸变成稀硫酸后反应停止,则被还原的硫酸的物质的量小于0.46mol,故A错误;
B.浓硫酸密度大于水,且稀释过程中放出大量热,若稀释该硫酸时应把水倒入硫酸中,会导致酸溶液飞溅,易发生危险,应该将浓硫酸盐玻璃杯缓缓倒入水中,故B错误;
C.根据计算可知,该浓硫酸的物质的量浓度为18.4molL,故C正确;
D.该硫酸为浓硫酸,常温下铝与浓硫酸发生钝化现象,且反应生成的不是氢气,故D错误;
点评 本题考查了物质的量浓度的计算与应用,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
19.下列说法正确的是( )
| A. | 任何油脂在碱性条件下水解都能生成甘油 | |
| B. | 蔗糖水解前后均可发生银镜反应 | |
| C. | 不同的单糖含有的官能团相同 | |
| D. | 向蛋白质中加入CuSO4溶液发生盐析 |
20.下列表达式正确的是( )
| A. | 小苏打溶液电离:NaHCO3═Na++H++CO32- | |
| B. | 明矾净水原理:Al3++3H2O?Al(OH)3↓+3H+ | |
| C. | 稀醋酸呈酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 重晶石的电离:BaSO4?Ba2++SO42- |
4.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液滴入沸水中制备Fe(OH)3胶体:$Fe_{\;}^{3+}$+$3OH_{\;}^-$═Fe(OH)3(胶体) | |
| B. | Cu溶于稀硝酸:Cu+2$H_{\;}^+$+$NO_3^-$═$Cu_{\;}^{2+}$+NO2↑+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 氯气溶于水:Cl2+H2O═2H++$Cl_{\;}^-$+$ClO_{\;}^-$ |
14.下列说法正确的是( )
| A. | 只要含有金属元素的化合物一定是离子化合物 | |
| B. | 全部元素都由非金属元素构成的化合物一定是共价化合物 | |
| C. | 离子化合物一定是电解质 | |
| D. | 共价化合物一定是非电解质 |
18.200℃时,11.6g由CO2和H2O组成的混合气体与足量Na2O2充分反应后,固体质量增加3.6g.则原混合气体的平均相对分子质量为( )
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
13.能证明乙醇分子中有一个羟基的是( )
| A. | 乙醇完全燃烧生成二氧化碳和水 | |
| B. | 乙醇能与水任意比混溶 | |
| C. | 乙醇在铜催化下可被氧化 | |
| D. | 0.1mol乙醇与足量的钠反应只能生成0.1g氢气 |

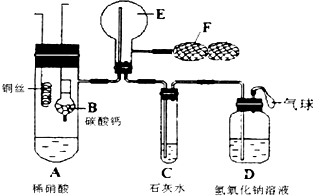 为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球.
为了证明铜和稀硝酸反应产生一氧化氮气体,某学校学生实验小组设计了一个实验,其装置如图所示(加热装置与固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是可控制气体流向,用于鼓入空气的双连打气球.