题目内容
20.下列表达式正确的是( )| A. | 小苏打溶液电离:NaHCO3═Na++H++CO32- | |
| B. | 明矾净水原理:Al3++3H2O?Al(OH)3↓+3H+ | |
| C. | 稀醋酸呈酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 重晶石的电离:BaSO4?Ba2++SO42- |
分析 A.电离生成钠离子和碳酸氢根离子;
B.铝离子水解不生成沉淀;
C.醋酸为弱酸,存在电离平衡;
D.硫酸钡为强电解质.
解答 解:A.小苏打溶液电离的离子反应为NaHCO3═Na++HCO3-,故A错误;
B.明矾净水原理,则水解离子反应为Al3++3H2O?Al(OH)3+3H+,故B错误;
C.稀醋酸呈酸性,电离方程式为CH3COOH+H2O?CH3COO-+H3O+,故C正确;
D.重晶石的电离方程式为BaSO4=Ba2++SO42-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意电离与水解的可逆性,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列化合物的俗称与化学式不对应的是( )
| A. | 绿矾-FeSO4•7H2O | B. | 石膏-CaSO4•2H2O | ||
| C. | 明矾-Al2(SO4)3•12H2O | D. | 胆矾-CuSO4•5H2O |
11.已知酸性KMnO4溶液可氧化C2H4生成CO2气体.则下列可用来鉴别CH4和C2H4,又可除去CH4中混有C2H4的方法是( )
| A. | 通入H2后加热 | B. | 通入酸性KMnO4溶液中 | ||
| C. | 通入足量的溴水中 | D. | 点燃 |
8.在0.1mol•L-1NaHCO3与0.1mol•L-1NaOH等体积混合所得的溶液中,粒子的物质的量浓度关系不正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3) | B. | c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | ||
| C. | c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | D. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
15.下列反应一定属于吸热反应的是( )
| A. | 破坏生成物全部化学键所需能量小于破坏反应物全部化学键的能量 | |
| B. | CH3COOH+KOH═CH3COOK+H2O | |
| C. | 所有高温条件下发生的反应 | |
| D. | C6H12O6(葡萄糖)+6O2═6CO2+6H2O |
12.下列关于环境、能源和材料的叙述中,错误的是( )
| A. | 光导纤维是以二氧化硅为主要原料制成的 | |
| B. | 在西部和沿海地区兴建风力发电站,解决能源短缺问题 | |
| C. | 糖类、油脂、蛋白质都属于天然有机高分子化合物 | |
| D. | 铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀 |
9.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| D. | 标准状况下2.7g Al与足量的该硫酸反应可得到H2 3.36L |
4.一些科学家预言,存在稳定的超重元素,如:Z=114,N=184的原子,它位于元素周期表的第7周期,第ⅣA族,下列说法正确的是( )
| A. | 第七周期有50种元素 | B. | 该原子的质量数为184 | ||
| C. | 该元素的相对原子质量为298 | D. | 该原子核外有114个电子 |


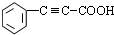 .
.
 、
、 .
. 的合成路线,其它无机试剂任选.
的合成路线,其它无机试剂任选.