题目内容
17.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如图:
(1)Na2SO3溶液在空气中存放,容易被氧化成Na2SO4(填化学式).检验是否存在该杂质的方法是:取少量溶液,加入过量稀盐酸,再加入BaCl2溶液,若有白色沉淀生成,则说明含有Na2SO4.
(2)操作X的名称为分液.
(3)通入Cl2发生反应的离子方程式Cl2+2I-=2I2+2Cl-.
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是使CCl4中的碘进入水层.
分析 由实验流程可知,含碘废液与亚硫酸钠发生SO32-+I2+H2O=2I-+2H++SO42-,反应后与CCl4分层,分液可分离出CCl4,再通入氯气发生Cl2+2I-=I2+2Cl-,富集、萃取、分液、蒸馏可得到碘,以此来解答.
解答 解:由实验流程可知,含碘废液与亚硫酸钠发生SO32-+I2+H2O=2I-+2H++SO42-,反应后与CCl4分层,分液可分离出CCl4,再通入氯气发生Cl2+2I-=I2+2Cl-,富集、萃取、分液、蒸馏可得到碘,
(1)Na2SO3溶液在空气中存放,容易被氧化成Na2SO4,检验是否存在该杂质的方法是取少量溶液,加入过量稀盐酸,再加入BaCl2溶液,若有白色沉淀生成,则说明含有Na2SO4,
故答案为:Na2SO4;取少量溶液,加入过量稀盐酸,再加入BaCl2溶液,若有白色沉淀生成,则说明含有Na2SO4;
(2)由上述分析可知,操作X为分液,故答案为:分液;
(3)通入Cl2发生反应的离子方程式为Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-;
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是使CCl4中的碘进入水层,从而与CCl4分层,便于分离,
故答案为:使CCl4中的碘进入水层.
点评 本题考查混合物分离提纯,为高频考点,把握分离流程中的反应、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应、分液法应用等,题目难度不大.

练习册系列答案
相关题目
8.在0.1mol•L-1NaHCO3与0.1mol•L-1NaOH等体积混合所得的溶液中,粒子的物质的量浓度关系不正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3) | B. | c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | ||
| C. | c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | D. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
12.下列关于环境、能源和材料的叙述中,错误的是( )
| A. | 光导纤维是以二氧化硅为主要原料制成的 | |
| B. | 在西部和沿海地区兴建风力发电站,解决能源短缺问题 | |
| C. | 糖类、油脂、蛋白质都属于天然有机高分子化合物 | |
| D. | 铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀 |
2.化学与环境、材料等关系密切,下列说法正确的是( )
| A. | 计算机芯片的主要成分是二氧化硅 | |
| B. | 碘盐能防治碘缺乏病,但必须科学合理摄入 | |
| C. | 用电镀废水直接灌溉农田,可提高水资源的利用率 | |
| D. | CO2是导致酸雨发生的主要原因 |
9.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| D. | 标准状况下2.7g Al与足量的该硫酸反应可得到H2 3.36L |
6.用下列装置完成相关实验,不合理的是( )


| A. | 用a趁热过滤提纯苯甲酸 | B. | 用b制备并检验乙烯 | ||
| C. | 用c分离溴苯与二溴苯混合物 | D. | 用d分离硝基苯与水 |

 .
.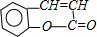 +H2O$\stackrel{酸}{→}$
+H2O$\stackrel{酸}{→}$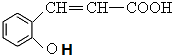 .
.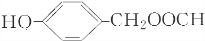 、
、 .
. 合成
合成


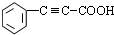 .
.
 、
、 .
. 的合成路线,其它无机试剂任选.
的合成路线,其它无机试剂任选. +HNO3(浓)$→_{50℃-60℃}^{浓硫酸}$
+HNO3(浓)$→_{50℃-60℃}^{浓硫酸}$ -NO2+H2O;取代反应
-NO2+H2O;取代反应