题目内容
15.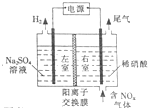 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).(1)若用NO2气体进行模拟电解法吸收实验.
①写出电解时NO2发生反应的电极反应式:NO2-e-+H2O=NO3-+2H+.
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为0.1mol.
(2)某小组在右室装有10 L 0.2 mol•L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验.
①实验前,配制10L0.2mol•L-1硝酸溶液,需量取142.9mL的密度为1.4 g•mL-1、质量分数为63%的浓硝酸.
②电解过程中,有部分NO转化为HNO2.实验结束时,测得右室溶液中含3molHNO3、0.1molHNO2,同时左室收集到标准状况下28LH2.计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程).
分析 (1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;故答案为:0.1;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρw}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒计算.
解答 解:(1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸,电极反应式为NO2-e-+H2O=NO3-+2H+,
故答案为:NO2-e-+H2O=NO3-+2H+;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室,
故答案为:0.1;
(2)①浓硝酸的物质的量浓度═$\frac{1000ρw}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算,所以浓硝酸体积=$\frac{0.2mol/L×10L}{14mol/L}$=142.9mL,
故答案为:142.9;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒得:x+y=1.1-0.1,3x+y=2.4,解得x=0.7,y=0.3,
n(NO):n(NO2)=(0.7+0.1)mol:0.3mol=8:3,相同条件下气体的体积之比等于物质的量之比,所以NO和二氧化氮的体积之比为8:3,
故答案为,8:3.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应及反应中存在的守恒是解本题关键,注意(2)②中电解后的硝酸还包含原来的硝酸,为易错点.

| A. | 该实验得到的NaCl中无其他任何杂质 | |
| B. | 检验所得NaCl中是否混有BaCl2,可用AgNO3溶液检验 | |
| C. | 该实验基本操作分为溶解、过滤和蒸发三个步骤 | |
| D. | 除去杂质时,不必考虑所加试剂的顺序 |
 我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )
我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( )| A. | 大力发展煤的气化及液化技术 | B. | 加快石油等化石燃料的开采和使用 | ||
| C. | 以CO2 为原料生产可降解塑料 | D. | 将秸秆进行加工转化为乙醇燃料 |
| A. | 二氧化硫可广泛用于食品的漂白 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 蛋白质和葡萄糖等高分子化合物是人体必需的营养物质 | |
| D. | 明矾可用作净水剂 |
①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2能与H2S反应生成S;④Cl原子最外层有7个电子,S原子最外层有6个电子;⑤Cl2比S更易与H2化合生成相应气态氢化物;⑥盐酸是强酸,而氢硫酸是弱酸.
| A. | ①②③④⑤⑥ | B. | ①②③④⑥ | C. | ①②③⑤ | D. | ②④⑥ |
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为 PH3和 HI 或 H2和 I2 | |
| C. | 这种化合物能跟碱反应 | |
| D. | 该化合物可以由 PH3 和 HI 化合而成 |
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题: .
.