题目内容
16.下列各组物质充分反应后,滴入KSCN溶液一定显红色的是( )| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
分析 各组物质充分反应后的产物中,滴入KSCN溶液显红色,说明反应后溶液中有Fe3+,铁离子与硫氰根离子发生了反应:Fe3++3SCN-?Fe(SCN)3,溶液显示红色,据此进行判断.
解答 解:A.FeO与稀盐酸反应生成的是亚铁离子,滴入硫氰化钾后溶液不显示红色,故A错误;
B、过量铁粉跟CuCl2反应生成亚铁离子,滴入硫氰化钾后溶液不显示红色,故B错误;
C、铁在氯气中燃烧生成FeCl3,滴入硫氰化钾后溶液显示红色,故C正确;
D、过量的铁粉和FeCl3反应生成FeCl2,滴入硫氰化钾后溶液不显示红色,故D错误;
故选C.
点评 本题考查铁离子的检验方法,难度不大.注意掌握铁离子的检验方法:KSCN溶液(红色),苯酚(紫色).

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
6.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质,X能形成多种单质,其中有两种单质硬度差异极大,下列说法中正确的是( )
| A. | 元素X只能形成一种氢化物 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(X)>r(Y) | |
| C. | 化合物Q中存在两种类型的共价键 | |
| D. | X与Z形成的化合物在熔融状态下能导电 |
7.用NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含3NA个离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
4.物质的量浓度相同的下列溶液中:①NH4Cl ②NH3•H2O ③(NH4)2SO4 ④NH4HSO4⑤NH4HCO3 c(NH4+)由大到小的顺序是( )
| A. | ⑤②③①④ | B. | ④①③②⑤ | C. | ③⑤④①② | D. | ③④①⑤② |
11.氨水中存在下述平衡:NH3+H2O?NH3•H2O?NH4++OH-.改变下列条件,能使电离程度增大的是( )
| A. | 加NH4Cl溶液 | B. | 加浓氨水 | C. | 加水稀释 | D. | 加NaOH溶液 |
1.下列说法正确的是( )
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
8.柠檬烯是一种食用香精,其结构简式如图.有关柠檬烯的分析正确的是( )


| A. | 柠檬烯的分子式为C10H14 | |
| B. | 它的一氯代物有8种 | |
| C. | 它和丁基苯互为同分异构体 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化反应,但不能发生还原反应 |
5.合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
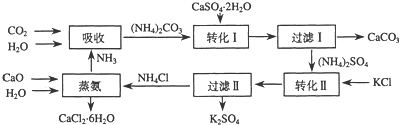
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体54g
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).

(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).