题目内容
4.物质的量浓度相同的下列溶液中:①NH4Cl ②NH3•H2O ③(NH4)2SO4 ④NH4HSO4⑤NH4HCO3 c(NH4+)由大到小的顺序是( )| A. | ⑤②③①④ | B. | ④①③②⑤ | C. | ③⑤④①② | D. | ③④①⑤② |
分析 ①NH4Cl ②NH3•H2O ③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3,先不考虑水解,则③(NH4)2SO4含有两个NH4+,所以它们NH4+的浓度大于其它四种物质,NH3•H2O,溶液中c(NH4+)小于铵盐的c(NH4+),再根据盐类的水解角度分析解答.
解答 解:物质的量浓度相同的下列溶液①NH4Cl ②NH3•H2O ③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3,先不考虑水解,则③(NH4)2SO4含有两个NH4+,所以它们NH4+的浓度大于其它四种物质,NH3•H2O,溶液中c(NH4+)小于铵盐的c(NH4+),①④⑤三种物质中,④NH4HSO4酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH4+)较大,
①NH4Cl,NH4+水解,④NH4HSO4,溶液中氢离子抑制铵根离子水解,即溶液中c(NH4+)④>①;
⑤NH4HCO3 ,HCO3- 水解促进铵根离子水解 溶液中c(NH4+)应最小,则①>⑤;
按c(NH4+)由大到小的顺序排列为:③>④>①>⑤>②,
故选:D.
点评 本题考查盐类水解的原理和应用,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析离子浓度的大小比较是解答的关键,题目难度中等.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
14.某些地区的水中可能含有下列盐类.当用新买来的铝壶烧水时,遇到水的地方会变成灰黑色,据此可以判断此地的水中含有( )
| A. | 钠盐 | B. | 钾盐 | C. | 铁盐 | D. | 钙盐 |
15.硫代硫酸钠(Na2S2O3)可作为还原剂,已知25.0mL0.0100mol/LNa2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
| A. | S2- | B. | S | C. | SO42- | D. | SO32- |
19.描述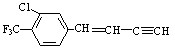 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )
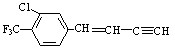 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
9.质量相等的下列烃,在相同条件下完全燃烧,耗氧量最多的是( )
| A. | CH4 | B. | C2H6 | C. | C2H4 | D. | C2H2 |
16.下列各组物质充分反应后,滴入KSCN溶液一定显红色的是( )
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
13.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
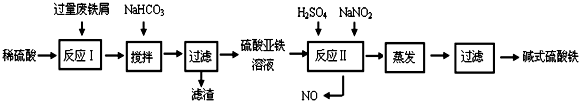
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内,使溶液中的Al3+离子沉淀.
(2)反应Ⅱ中加入NaNO2,反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标准状况),则相当于节约NaNO2的物质的量为1mol.
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合
离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.K3Fe(CN)6溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内,使溶液中的Al3+离子沉淀.
(2)反应Ⅱ中加入NaNO2,反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标准状况),则相当于节约NaNO2的物质的量为1mol.
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合
离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.K3Fe(CN)6溶液.
14.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;
(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;
(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |