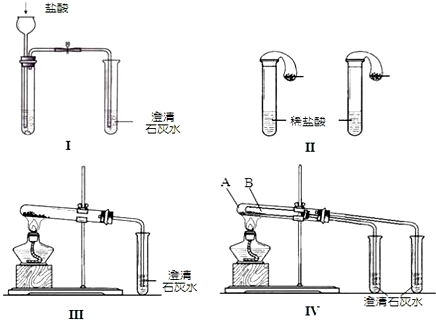
题目内容
14.1mol•L-1NaCl溶液的含义是( )| A. | 1 L水中含有1 mol NaCl | |
| B. | 溶液中含有1 mol NaCl | |
| C. | 1 L溶液中含有1 molNaCl | |
| D. | 将58.5 g NaCl溶于1 L水中所得的溶液 |
分析 1mol•L-1NaCl溶液,根据物质的量浓度的概念可知,1L NaCl溶液中含有溶质 NaCl1mol,1mol NaCl的质量为58.5g,据此进行判断.
解答 解:1mol•L-1NaCl溶液是指:1L该氯化钠溶液中含有溶质NaCl的物质的量为1mol,1molNaCl的质量为:58.5g/mol×1mol=58.5g,所以1mol•L-1NaCl溶液的含义是:1L溶液中含有1molNaCl(或58.5 g)NaCl,故选C.
点评 本题考查了物质的量浓度概念及意义,题目难度不大,注意掌握物质的量浓度的概念,明确物质的量浓度表示的意义.

练习册系列答案
相关题目
9.下列操作中不属于萃取的是( )
| A. | 从青蒿中提取青蒿素 | B. | 从溴水中提取溴单质 | ||
| C. | 浸泡药酒 | D. | 海水淡化 |
6.下列实验可行的是( )
| A. | 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质 | |
| B. | 用乙醇从碘水中萃取碘 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用食醋浸泡有水垢的水壶清除其中的水垢 |
3.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向溶液X的稀溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 溶液X中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
4.某化学课外学习小组为研究一种常用于水净化以及工业水处理的物质A的成分,进行了如下探究活动:
(1)查阅资料,获得下列信息:
①化合物A在工业上一般用铝土矿为原料,通过下列流程制备:
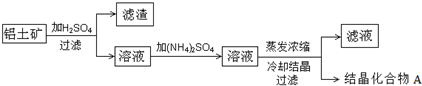
②化合物A是一种白色透明晶体,易溶于热水,水溶液呈酸性;
(2)实验探究:
请根据以上探究结果,回答下列问题:
(1)请写出铝土矿与硫酸主要反应的离子方程式Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O.
(2)结晶水合物A的化学式为NH4Al(SO4)2•12H2O.
(3)A用作净水剂的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
(4)气体B可与空气构成燃料电池,生成稳定的单质和水,请写出以KOH为电解质,该燃料电池的负极电极反应式2NH3-6e-+6OH-=N2+6H2O.
(1)查阅资料,获得下列信息:
①化合物A在工业上一般用铝土矿为原料,通过下列流程制备:

②化合物A是一种白色透明晶体,易溶于热水,水溶液呈酸性;
(2)实验探究:
| 实验 | 实验步骤 | 实验结果 |
| ① | 称取9.06g的结晶化合物A加热 | 加热到质量恒定时,质量减轻了4.32g; |
| ② | 将加热后所得的固体分成两等份,分别加适量的水,制成溶液. | |
| ③ | 在一份溶液中加入足量的BaCl2溶液. | 产生4.66g 白色沉淀; |
| ④ | 在另一份溶液中,逐滴加入2mol•L-1的NaOH溶液. | 先观察到产生白色沉淀,接着产生有刺激性气味的气体B,沉淀逐渐溶解,当加入25mL的氢氧化钠溶液时,沉淀恰好完全溶解. |
(1)请写出铝土矿与硫酸主要反应的离子方程式Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O.
(2)结晶水合物A的化学式为NH4Al(SO4)2•12H2O.
(3)A用作净水剂的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
(4)气体B可与空气构成燃料电池,生成稳定的单质和水,请写出以KOH为电解质,该燃料电池的负极电极反应式2NH3-6e-+6OH-=N2+6H2O.
 .
. ;
;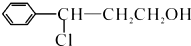 →Y:
→Y: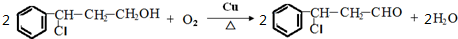 .
. .
.

 ;
;

 .
. ,该物质在NaOH水溶液中加热反应时的化学方程式为
,该物质在NaOH水溶液中加热反应时的化学方程式为 +5NaOH$→_{△}^{H_{2}O}$
+5NaOH$→_{△}^{H_{2}O}$ +HOCH2CH2OH+Na2CO3+NaCl+2H2O.
+HOCH2CH2OH+Na2CO3+NaCl+2H2O.