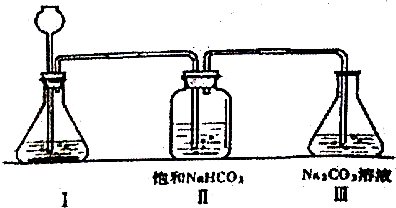
题目内容
2.铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸,放电时该电池的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O.试根据上述信息回答下列问题:(1)蓄电池的负极材料是Pb.
(2)放电时,正极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O.
(3)放电时,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
(4)放电时,电解质溶液中阴离子移向负极.
分析 (1)根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,得电子化合价降低的反应物为正极、失电子化合价升高的金属为负极;
(2)放电时,正极上PbO2得电子和H2SO4反应生成PbSO4;
(3)放电时,H2SO4参加反应导致溶液中c(H+)降低;
(4)放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动.
解答 解:(1)根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,失电子化合价升高的金属为负极,则Pb为负极,故答案为:Pb;
(2)放电时,正极上PbO2得电子和H2SO4反应生成PbSO4,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(3)放电时,H2SO4参加反应导致溶液中c( H+)降低,则溶液pH增大、酸性减小,故答案为:增大;
(4)放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,故答案为:负.
点评 本题考查了原电池原理,明确正负极上发生反应及元素化合价变化即可解答,知道电流方向、电解质溶液中阴阳离子移动方向等知识点,题目难度不大.

练习册系列答案
相关题目
13.①质子数相同的微粒一定是同种元素;②同位素的化学性质基本相同;③质子数相同、电予数也相同的两种微粒,不可能是一种分并不和一种离子;④电子数相同的微粒不,一定是同一种原子;⑤某种元素的相对原子质量取整数,就是其质量数:以上说法中正确组合是( )
| A. | ①⑤ | B. | ②③④ | C. | ①②⑤ | D. | ③④⑤ |
10.对于反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1mol的NaClO3转移10mol的电子 | |
| C. | Cl2既是氧化剂又是还原剂 | |
| D. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5 |
7. 我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )
我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )
 我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )
我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )| A. | 该电池工作时将电能转化为化学能 | |
| B. | 通常一段时间后该电池只需更换铝板就可继续使用 | |
| C. | 负极反应式是:O2+2H2O+4e-=4OH- | |
| D. | 铝片发生还原反应 |
14.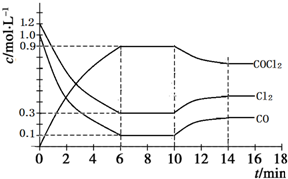 在1L恒容密闭容器中发生如下反应:Cl2(g)+CO(g)?COCl2(g)△H<0,图为容器内各物质的浓度随时间变化的曲线.下列说法不正确的是( )
在1L恒容密闭容器中发生如下反应:Cl2(g)+CO(g)?COCl2(g)△H<0,图为容器内各物质的浓度随时间变化的曲线.下列说法不正确的是( )
 在1L恒容密闭容器中发生如下反应:Cl2(g)+CO(g)?COCl2(g)△H<0,图为容器内各物质的浓度随时间变化的曲线.下列说法不正确的是( )
在1L恒容密闭容器中发生如下反应:Cl2(g)+CO(g)?COCl2(g)△H<0,图为容器内各物质的浓度随时间变化的曲线.下列说法不正确的是( )| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15mol•L-1•min-1 | |
| B. | 由图可知,第10 min时改变的外界条件是升温 | |
| C. | 保持温度不变,第8 min 时加入体系中的三种物质各1 mol,则平衡向逆反应方向移动 | |
| D. | 保持温度不变,若第10 min时向容器中再充入0.6 molCl2、0.5 molCO,则Cl2转化率增大 |
11.如图所示的某有机反应,其反应类型为( )


| A. | 加成反应 | B. | 取代反应 | C. | 加聚反应 | D. | 置换反应 |
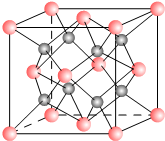 一种离子晶体的晶胞如右图.其中阳离子A以
一种离子晶体的晶胞如右图.其中阳离子A以