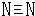题目内容
12.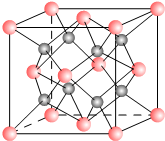 一种离子晶体的晶胞如右图.其中阳离子A以
一种离子晶体的晶胞如右图.其中阳离子A以(1)每个晶胞种含A离子的数目为4,含B离子数目为8.
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是CaF2;
(3)阳离子的配位数为8,阴离子的配位数为4.
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是16$\sqrt{2}{r}^{3}$m3.
分析 (1)利用均摊法计算离子数目;
(2)根据离子的化合价及与其电子层结构相同的惰性气体元素判断该离子元素,从而写出其化学式;
(3)阳离子周围距离最近的阴离子数为8,阴离子周围距离最近的阳离子数是4;
(4)根据A离子的半径金属晶胞的边长,再利用体积公式计算.
解答 解:(1)每个晶胞中含A离子的数目=8×$\frac{1}{8}$=4,含B离子数目为8,
故答案为:4;8;
(2)通过(1)知,该物质的化学式为:AB2,A是金属阳离子,则A的化合价是+2价,若A的核外电子排布与Ar相同,则A是Ca元素,B的化合价是-1价,且B的电子排布与Ne相同,则B是F元素,则该离子化合物的化学式是CaF2,
故答案为:CaF2;
(3)阳离子周围距离最近的阴离子数为8,阴离子周围距离最近的阳离子数是4,
故答案为:8;4;
(4)该晶胞中正方形对角线的长度=4rm,则该晶胞的边长=2$\sqrt{2}$rm,则该晶胞的体积=(2$\sqrt{2}$rm)3=16$\sqrt{2}$r3 m3,
故答案为:16$\sqrt{2}$r3 .
点评 本题考查了晶胞的有关计算,难点是配位数、晶胞体积的计算,注意晶胞边长不等于A离子直径,为易错点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
2. 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
加热聚丙烯废塑料得到的产物如表:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔.
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔
写出反应②、③的化学方程式②CaC2+2H2O→Ca(OH)2+C2H2↑,③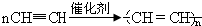 .
.
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质是甲苯(填名称),该物质与硝酸制取一种淡黄色晶体、烈性炸药的化学方程式为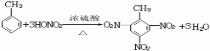 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔
写出反应②、③的化学方程式②CaC2+2H2O→Ca(OH)2+C2H2↑,③
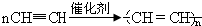 .
.(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质是甲苯(填名称),该物质与硝酸制取一种淡黄色晶体、烈性炸药的化学方程式为
 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
3.用表中指定的阳极和阴极电解一定组成的甲溶液,然后加入一定量物质乙,能使溶液恢复到原来组成的甲溶液的正确组合是( )
| 组别 | 阳极 | 阴极 | 甲溶液 | 物质乙 |
| A | Ag | Cu | AgNO3溶液 | AgNO3固体 |
| B | C | Cu | CuSO4溶液 | Cu(OH)2 |
| C | Pt | Pt | NaOH溶液 | NaOH固体 |
| D | C | Fe | NaCl溶液 | HCl |
| A. | A | B. | B | C. | C | D. | D |
17. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
(1)写出化合物Y所含的化学键名称离子键、共价键;
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH→CH3CH2ONa+H2↑.
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为30%;
(5)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(6)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH→CH3CH2ONa+H2↑.
1.下列说法正确的是( )
| A. | 食用白糖的主要成分是蔗糖 | |
| B. | 油脂、淀粉和蛋白质都是高分子化合物 | |
| C. | 油脂不能使溴水褪色 | |
| D. | 乙酸乙酯和食用油都可以水解生成乙醇 |

 (I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质.
(I)由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质. ,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为
,A既能与强酸又能与强碱反应,且都能产生气体,请画出A的电子式为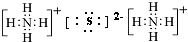 或
或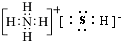 .
.