题目内容
4.下列实验方案能达到实验目的是( )| A. | 证明浓度的改变可导致平衡移动:将少量KCl晶体加入FeCl3+3KSC?Fe(SCN)3+3KCl的平衡体系中 | |
| B. | 除去MgCl2溶液中少量的FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤 | |
| C. | 检验某溶液中是否含有乙醛:向盛有2mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热 | |
| D. | 证明Fe3+的氧化性大于I2:将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 |
分析 A.反应的本质为Fe3++3SCN-?Fe(SCN)3,氯化钾不影响该化学平衡;
B.氢氧化铁更难溶,实现了沉淀的转化;
C.配制氢氧化铜浊液时,加入的氢氧化钠必须足量;
D.下层溶液显紫红色,有碘单质生成,可以证明铁离子的氧化性大于碘离子.
解答 解:A.反应FeCl3+3KSC?Fe(SCN)3+3KCl的本质是:Fe3++3SCN-?Fe(SCN)3,KC1浓度的改变对平衡无影响,故A错误;
B.由于氢氧化铁比氢氧化镁难溶,向含有少量FeCl3的MgCl2溶液中加入足量的Mg(OH)2粉末,将氯化铁转化成氢氧化铁沉淀,然后搅拌一段时间后过滤,可以除去MgCl2溶液中少量的FeCl3,故B正确;
C.乙醛与氢氧化铜的反应必须在碱性条件下进行,加入的NaOH不足,无法完成该实验,故C错误;
D.将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色,说明有碘单质生成,可以证明Fe3+的氧化性大于I2,故D正确;
故选BD.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及化学平衡及其影响、难溶物溶解平衡及沉淀转化实质、氧化性强弱比较等知识,明确化学平衡及其影响为解答关键,试题知识点较多,充分考查学生的分析能力及灵活应用能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
16.已知短周期主族元素X、Y、Z、W、R五种元素,原子序数依次增大,X元素的原子是所有元素中原子半径最小的,Y、W同主族,Z、W同周期.X与Y可形成具有18个电子的化合物G,在酸性条件下,在含W阴离子的溶液中加入G可得到W单质.Z是同周期中金属性最强的元素.下列说法不正确的是( )
| A. | 原子半径:X<Y<W<R<Z | |
| B. | 由Y、Z元素可形成两种离子化合物其阳离子与阴离子物质的量之比都是2:1 | |
| C. | 沸点:X2Y>X2W | |
| D. | w与R可形成共价化合物WR2,且WR2是极性分子 |
17.下列实验操作和现象所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液 | NaNO3溶液为无色,Na2SiO3溶液变成红色 | 非金属性:N>Si |
| B | 将湿润的KI-淀粉试纸置于集满某气体的集气瓶口 | 试纸变蓝 | 该气体为Cl2 |
| C | 将浓盐酸滴入NaHSO3溶液,所得气体依次通过浓硫酸和CuSO4,收集气体 | CuSO4颜色未发生改变 | 收集到纯净的SO2 |
| D | 向含有少量FeCl3的FeCl2溶液中加入铜粉 | 铜粉有剩余 | 所得溶液中的溶质只有FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
13.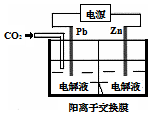 采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
 采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )| A. | Pb与电源的正极相连 | |
| B. | ZnC2O4在离子交换膜右侧生成 | |
| C. | 正极反应式为:Zn-2e-═Zn2+ | |
| D. | 标准状况下,当11.2 L CO2参与反应时,转移0.5mol电子 |
19.在给定条件下,下列选项中物质间的转化均能一步实现的是( )
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
8.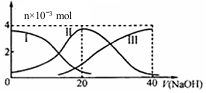 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )| A. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2-)>c(H+)>c(HA-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HA-)=c(A2-)+2c(OH-) | |
| D. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
12.已知甲烷和汽油(可用C8H18表示)的燃烧的热化学方程式:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1;
C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=-5472kJ•mol-1;
某学校食堂拟选用天然气作为供热燃料,下列选择依据不正确的是( )
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1;
C8H18(l)+12.5O2(g)═8CO2(g)+9H2O(l)△H=-5472kJ•mol-1;
某学校食堂拟选用天然气作为供热燃料,下列选择依据不正确的是( )
| A. | 等质量的汽油和甲烷燃烧,甲烷产生的热量比汽油多,因此甲烷更高效 | |
| B. | 产生相同热量所生成的二氧化碳,汽油比甲烷多,因此甲烷更低效 | |
| C. | 甲烷含碳量低,燃烧更充分,不易积炭,不易产生CO,因此更环保 | |
| D. | 等物质的量的汽油和甲烷燃烧,汽油产生的热量比甲烷多,因此更环保 |
13.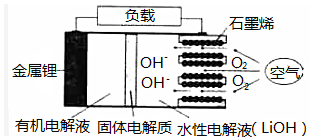 新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )
新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )
 新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )
新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )| A. | 放电时,负极反应式:Li-e-+OH-═LiOH | |
| B. | 放电时,当外电路中有1mole-转移时,水性电解液离子总数增加NA | |
| C. | 应用该电池电镀铜,阴极质量增加64g,理沦上将消耗11.2LO2 | |
| D. | 若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞 |

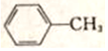 ,G的名称是苯甲醛.
,G的名称是苯甲醛.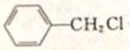 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$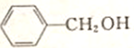 +NaCl.
+NaCl. .
. 以物质的量之比2:1反应得到化合物的结构简式为
以物质的量之比2:1反应得到化合物的结构简式为 .
.