题目内容
17.请以乙醇为原料设计合成 的方案.依次写出合成方案中所涉及反应的化学方程式.
的方案.依次写出合成方案中所涉及反应的化学方程式.
分析 以乙醇为原料设计合成 ,
, 由HOCH2CH2OH发生取代反应生成的,HOCH2CH2OH可以由BrCH2CH2Br发生水解得到,则BrCH2CH2Br可以由CH2=CH2和溴发生加成反应得到,CH2=CH2可以由CH3CH2OH发生消去反应得到,据此分析解答.
由HOCH2CH2OH发生取代反应生成的,HOCH2CH2OH可以由BrCH2CH2Br发生水解得到,则BrCH2CH2Br可以由CH2=CH2和溴发生加成反应得到,CH2=CH2可以由CH3CH2OH发生消去反应得到,据此分析解答.
解答 解:以乙醇为原料设计合成 ,
, 由HOCH2CH2OH发生取代反应生成的,HOCH2CH2OH可以由BrCH2CH2Br发生水解得到,则BrCH2CH2Br可以由CH2=CH2和溴发生加成反应得到,CH2=CH2可以由CH3CH2OH发生消去反应得到,所以其合成路线为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$BrCH2CH2Br$→_{△}^{H_{2}ONaOH}$HOCH2CH2OH$→_{△}^{浓硫酸}$
由HOCH2CH2OH发生取代反应生成的,HOCH2CH2OH可以由BrCH2CH2Br发生水解得到,则BrCH2CH2Br可以由CH2=CH2和溴发生加成反应得到,CH2=CH2可以由CH3CH2OH发生消去反应得到,所以其合成路线为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$BrCH2CH2Br$→_{△}^{H_{2}ONaOH}$HOCH2CH2OH$→_{△}^{浓硫酸}$  ,涉及的方程式分别为:
,涉及的方程式分别为:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
Br2+CH2=CH2 →BrCH2CH2Br,
BrCH2CH2Br+H2O$→_{△}^{NaOH}$HOCH2CH2OH+2HBr,
HOCH2CH2OH$→_{△}^{浓硫酸}$  +2H2O,
+2H2O,
故答案为:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
Br2+CH2=CH2 →BrCH2CH2Br,
BrCH2CH2Br+H2O$→_{△}^{NaOH}$HOCH2CH2OH+2HBr,
HOCH2CH2OH$→_{△}^{浓硫酸}$  +2H2O.
+2H2O.
点评 本题考查有机设计,为高频考点,明确常见有机物官能团及其性质、常见有机反应类型及反应条件是解本题关键,根据反应物和生成物特点采用逆向思维分析解答,需要学生具有综合应用能力,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案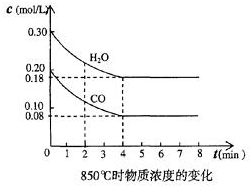 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=0.03 mol/(L•min)
t1时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3min~4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.

实验过程中所用的物质x,y及pH控制参照下表确定:表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | E | 氨水 |
| B | 高锰酸钾 | F | 碱式碳酸铜 |
| C | 氯水 | G | 氧化铜 |
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| C. | 向小苏打溶液中加入醋酸:HCO3-+H+═CO2↑+H2O | |
| D. | 乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$Cu2O↓+CH3COO-+3H2O |
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 往CaCl2溶液中通入少量的CO2 Ca2++CO2+H2O═CaCO3↓+2H+ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 34S原子核内的中子数为16 | B. | 16O与18O互称同位素 | ||
| C. | 13C和15N原子核内的质子数相差2 | D. | 2H的核外电子数比1H多一个 |
| A. | HCO3-+H2O?CO32-+H3O+ | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | NaHCO3?Na++HCO3- | D. | H2S?2H++S2- |