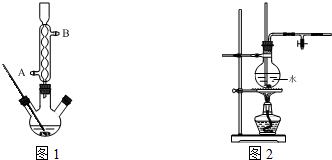
题目内容
20.某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )| A. | NH4+、Mg2+ | B. | Mg2+、Fe2+ | C. | NH4+、Fe2+ | D. | Mg2+、Al3+ |
分析 NH4+与碱在微热时反应生成氨气逸出,则铵根离子减少,Fe2+和氢氧化钠溶液反应生成的Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,则Fe2+减少,以此来解答.
解答 解:混合溶液中加入过量的NaOH并加热时,反应生成的氨气逸出,并同时生成Mg(OH)2、Fe(OH)2沉淀和NaAlO2,
Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3,
再向混合物中加入过量盐酸,则Mg(OH)2、Fe(OH)3和NaAlO2与过量酸作用分别生成MgCl2、AlCl3、FeCl3,
则减少的阳离子主要有NH4+和Fe2+,
故选C.
点评 本题考查离子之间的反应,明确阳离子与碱反应后的生成物的性质及生成物与酸的反应是解答本题的关键,注意亚铁离子易被氧化是学生解答中容易忽略的地方,题目难度中等.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 在25℃、1.01×105Pa的条件下,2.24 L H2中含有的分子数小于0.1NA | |
| B. | 1 L 1 mol•L-1的CaCl2溶液中含Cl-的数目为NA | |
| C. | 在标准状况下,22.4 L H2O的质量约为18 g | |
| D. | 22 g CO2与标准状况下11.2 L H2O含有相同的分子数 |
11.下列有关操作正确的是( )
| A. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| B. | 相对分子质量相同的不同物质一定是同分异构体 | |
| C. | 淀粉和纤维素的分子式相同,所以两者互为同分异构体 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
15.M、Q、R、V为分别占有前3周期的元素,其原子序数依次增加,M和R、Q和V属于同一主族,且它们的最外层电子数之和为14,下列说法中正确的是( )
| A. | 单质的沸点:M>Q | |
| B. | Q元素的阴离子和V元素的阴离子都只有还原性 | |
| C. | Q与R可以组成2种离子化合物 | |
| D. | M、Q、R、V四种元素组成的化合物的水溶液可以是碱性、中性和酸性 |
5.由乙醇制取乙二酸乙二酯( 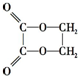 )时最合理的合成路线需经下列反应:
)时最合理的合成路线需经下列反应:
①取代反应
②加成反应
③氧化反应
④还原反应
⑤消去反应
⑥酯化反应
下列有关合成乙二酸乙二酯的过程中反应类型的顺序正确的是( )
 )时最合理的合成路线需经下列反应:
)时最合理的合成路线需经下列反应:①取代反应
②加成反应
③氧化反应
④还原反应
⑤消去反应
⑥酯化反应
下列有关合成乙二酸乙二酯的过程中反应类型的顺序正确的是( )
| A. | ①②③⑤⑥ | B. | ⑤②①③⑥ | C. | ⑥③①②⑤ | D. | ①②⑤③⑥ |
12.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 还原性 B>A>D>C |
9.下列反应,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | C6H6十Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH3+H2O |
1.下列物质中,摩尔质量最大的是( )
| A. | 1 g Na2CO3 | B. | 0.1mol CaCO3 | C. | 56 g Fe | D. | 10 mLH2O |
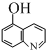 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: