题目内容
7.有关碳元素及其化合物的化学用语正确的是( )| A. | CO2的电子式: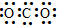 | B. | 碳原子最外层电子的轨道表示式: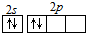 | ||
| C. | 淀粉分子的最简式:CH2O | D. | 乙烯分子的比例模型 |
分析 A.表示原子或离子最外层电子结构的式子.原子的电子式是在元素符号的周围用小黑点(或×)表示原子的最外层电子;二氧化碳分子中,碳原子和氧原子形成的是双键;
B.原子轨道表示式遵循洪特规则,电子尽可能分占本题轨道;
C.最简式为分子中各原子的最简比;
D.比例模型是参照原始实物,按照一定的比例缩放制作的模型.
解答 解:A.二氧化碳分子中含有两个碳氧双键,其正确的电子式为 ,故A错误;
,故A错误;
B.C原子最外层电子的轨道表示式为: ,故B错误;
,故B错误;
C.淀粉是由C、H、O三种元素组成的高分子聚合物,分子式表示为(C6H10O5)n,其最简式为C6H10O5,故C错误;
D.乙烯的比例模型为: ,符合比例模型的要求,故D正确;
,符合比例模型的要求,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型、最简式、电子式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
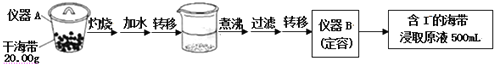
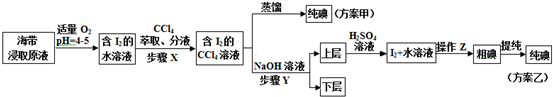
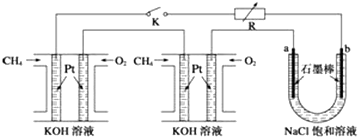
17.随着环保意识增强,清洁能源越来越受到人们关注.
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3 kJ•mol-1
H2O(1)═H2O(g),△H=+44.0 kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.09kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1 kJ•mol-l.
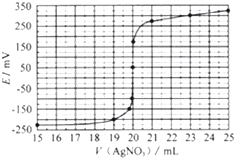
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表
则此时正逆反应速率的关系式a.(填序号)
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述反应的影响,某学习小组进行了以下三组对比实验温度为360℃或480℃、压强为101 kPa或303 kPa.
表中P1=303,P2=101; 实验2、3的目的是研究温度对化学反应速率的影响.
实验l、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3 kJ•mol-1
H2O(1)═H2O(g),△H=+44.0 kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.09kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1 kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述反应的影响,某学习小组进行了以下三组对比实验温度为360℃或480℃、压强为101 kPa或303 kPa.
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
实验l、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
18.下列不与单质铜反应(必要时可加热)的是( )
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 稀盐酸 | D. | 氯化铁溶液 |
15.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量15%的Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
12.下列叙述正确的是( )
| A. | SO2的水溶液能导电,所以SO2是电解质 | |
| B. | 酸式盐的水溶液呈酸性 | |
| C. | 盐类水解是中和反应的逆反应 | |
| D. | 凡是强酸生成的盐,其水溶液呈中性 |
19.23592U是制造原子弹的材料和核反应堆的燃料,该原子的中子数是( )
| A. | 92 | B. | 235 | C. | 143 | D. | 327 |
17.某铁的“氧化物”样品,用5mol/L盐酸50mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe5O7 |