题目内容
17.某铁的“氧化物”样品,用5mol/L盐酸50mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe5O7 |
分析 该氧化物和稀盐酸发生复分解反应生成氯化物和水,HCl是强电解质,所以盐酸溶液中存在n(Cl-)=n(HCl)=5mol/L×0.05L=0.25mol,根据溶液呈电中性得铁元素所带电荷物质的量为0.25mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,根据转移电子相等得n(Fe2+)=$\frac{0.025mol×2}{1}$=0.05mol,
根据电荷守恒得n(Fe 3+)=$\frac{0.25mol-0.05mol×2}{3}$=0.05mol,氧化物中O元素和盐酸中H+结合生成H2O,根据水的化学式知,n(O)=$\frac{1}{2}$n(H+)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.25mol=0.125mol,据此确定氧化物化学式.
解答 解:该氧化物和稀盐酸发生复分解反应生成氯化物和水,HCl是强电解质,所以盐酸溶液中存在n(Cl-)=n(HCl)=5mol/L×0.05L=0.25mol,根据溶液呈电中性得铁元素所带电荷物质的量为0.25mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,根据转移电子相等得n(Fe2+)=$\frac{0.025mol×2}{1}$=0.05mol,
根据电荷守恒得n(Fe 3+)=$\frac{0.25mol-0.05mol×2}{3}$=0.05mol,氧化物中O元素和盐酸中H+结合生成H2O,根据水的化学式知,n(O)=$\frac{1}{2}$n(H+)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.25mol=0.125mol,则氧化物中Fe、O元素物质的量之比=(0.05+0.05)mol:0.125mol=4:5,所以其化学式为Fe4O5,故选C.
点评 本题考查化学方程式的计算,为高频考点,明确各个物理量关系是解本题关键,注意电荷守恒、原子守恒的灵活运用,难点是等量代换的应用,题目难度中等.

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | CO2的电子式: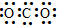 | B. | 碳原子最外层电子的轨道表示式: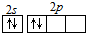 | ||
| C. | 淀粉分子的最简式:CH2O | D. | 乙烯分子的比例模型 |
| A. | v正(X)=2v正(Y) | |
| B. | 单位时间内生成1 mol Y的同时生成2molX | |
| C. | 混合气体的密度不再变化 | |
| D. | 反应容器中Y的质量分数不变 |
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
| A. | 0.1mol•L-1的HA溶液中由水电离出的c(H+)>1×10-13mol/L | |
| B. | c1一定大于0.2 mol•L-1 | |
| C. | 甲反应后的溶液中:HA占含A-微粒总数的0.01% | |
| D. | 乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
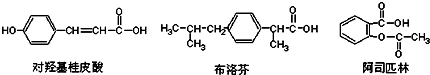
下列说法正确的是( )
| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
| A. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | AlCl3溶液中滴加过量的氨水:Al3++4 NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 铜与浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向小苏打溶液中滴入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
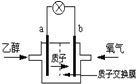 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | 电池工作时,1mol乙醇被氧化时就有6mol电子转移 | |
| B. | a极为电池的负极 | |
| C. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| D. | 电池正极的电极反应为:4H++O2+4e-═2H2O |
| A. | 100mL | B. | 200mL | C. | 150mL | D. | 50mL |
| A. | 纯锌与稀硫酸 | B. | 粗锌与稀硝酸 | C. | 纯锌与浓硫酸 | D. | 粗锌与稀硫酸 |