题目内容
1.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关.下列各组物质由浓度不同而能发生不同氧化还原反应的是( )①Cu与HNO3溶液
②Cu与FeCl3溶液
③NH4Cl与NaOH溶液
④Fe与HCl溶液.
| A. | ① | B. | ①③ | C. | ①② | D. | ①③④ |
分析 ①与硝酸的浓度有关;
②与量及浓度无关;
③反应生成氯化钠、一水合氨(或氨气、水);
④与浓度无关.
解答 解:①Cu与浓HNO3溶液反应生成硝酸铜、二氧化氮与水,Cu与稀HNO3溶液反应生成硝酸铜、NO与水,由浓度不同而能发生不同氧化还原反应,故选;
②Cu与FeCl3溶液反应生成氯化铜、氯化亚铁,与浓度无关,故不选
③NH4Cl与NaOH溶液发生复分解反应,无元素的化合价变化,故不选;
④Fe与HCl溶液反应生成氯化亚铁和氢气,与浓度无关,故不选;
故选A.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意浓度对反应的影响,题目难度不大.

练习册系列答案
相关题目
9.下列各对原子序数的原子能以共价键结合成化合物的是( )
| A. | 9和11 | B. | 6和1 | C. | 11和1 | D. | 12和17 |
18.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不同 | |
| B. | 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | |
| C. | 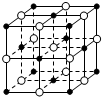 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元 | |
| D. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为NA |
19.已知有转化关系: $\stackrel{③}{→}$C2H5Br,则反应①、②、③的反应类型分别为( )
$\stackrel{③}{→}$C2H5Br,则反应①、②、③的反应类型分别为( )
 $\stackrel{③}{→}$C2H5Br,则反应①、②、③的反应类型分别为( )
$\stackrel{③}{→}$C2H5Br,则反应①、②、③的反应类型分别为( )| A. | 取代反应、加成反应、取代反应 | B. | 取代反应、取代反应、加成反应 | ||
| C. | 氧化反应、加成反应、加成反应 | D. | 氧化反应、加成反应、取代反应 |

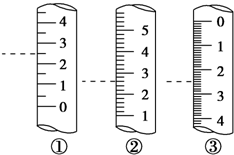 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
 ,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.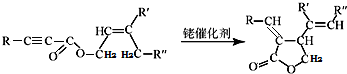
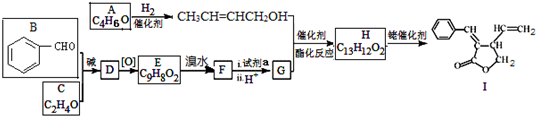
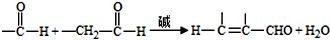
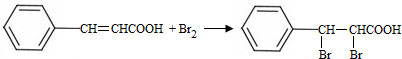 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.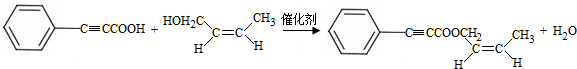 .
.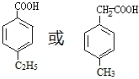 (写出一种即可).
(写出一种即可). 和CH3CHO为原料合成
和CH3CHO为原料合成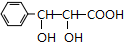 的合成路线流程图:
的合成路线流程图: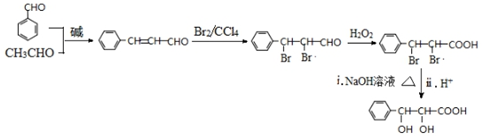 .(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
.(其它试剂任选,合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)