题目内容
10. 回答下列问题
回答下列问题(1)向一体积不变的密闭容器中加入2molNO2气体,发生反应2NO2(g)?N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a<b(填“>”“=”“<”,)
(2)已知胆矾溶于水时溶液温度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l)△H=+Q1 mol•L-1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1>Q2(填写>,=或<)
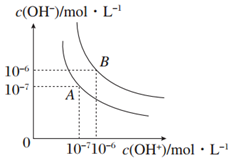
(3)水的电离平衡曲线如图所示,若以A点表示25℃时水电离平衡的离子的浓度,当温度升高至100℃时,水的电离平衡状态变为了B点,则
①25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为1:9.
②pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸体积之比为2:9.
③100℃时若10体积的某强酸溶液与1体积的某强碱溶液混合后,溶液呈中性,则混合前该强酸的pH与强碱的pH之间应满足的关系式是pH酸+pH碱=13.
分析 (1)据压强增大时,平衡向气体体积减小的方向移动分析;
(2)胆矾溶于水时可分为两步,一是胆矾分解成无水硫酸铜,二是无水硫酸铜溶解,然后结合盖斯定律来解答;
(3)①设出氢氧化钠溶液为x和硫酸溶液的体积为y,根据题中数据列式计算出体积之比;
②设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比;
③设出酸溶液的pH为a,碱溶液的pH为b,根据100℃时及体积关系列式计算.
解答 解:(1)体积不变,温度不变的条件下,再向该容器加入1molN2O4,由于生成物浓度增大,平衡逆向移动,但逆向移动时压强增大,所以,移动的结果不如原平衡,所以,N2O4的体积分数比原平衡大,故答案为:<;
(2)胆矾溶于水时溶液温度降低,可知其为吸热过程,△H>0,
1mol胆矾分解生成1molCuSO4(s)时,CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l)△H=+Q1 KJ•mol-1
1molCuSO4(s)溶解时放热Q2 kJ
可得如下图所示关系,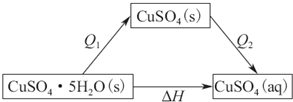
根据盖斯定律,则有△H=Q1+(-Q2)>0,则Q1>Q2,
故答案为:>;
(3)①设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=11的NaOH溶液中,氢氧根离子的浓度为:10-3mol/L,pH=4的硫酸溶液中氢离子浓度为:10-4mol/L,
二者混合后溶液的pH=9,溶液酸性碱性,溶液中氢氧根离子的浓度为10-5mol/L,即氢氧化钠过量,即10-3mol/L×xL-10-4mol/L×y=10-5mol/L(x+y),
解得x:y=1:9,
故答案为:1:9;
②设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-4mol/L,
pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
欲使混合溶液pH=7,溶液此时显碱性,即混合后c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=1×10-5mol/L,即$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=1×10-5mol/L,解得x:y=2:9,
故答案为:2:9;
③设强酸溶液的pH为a,体积为10V,溶液中氢离子浓度为:10-amol/L;碱溶液的pH为b,体积为V,溶液中氢氧根离子的浓度为:10-(12-b)mol/L,
混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10-amol/L×10VL=10-(12-b)mol/L×VL,
解得:1-a=b-12,a+b=13,
故答案为:pH酸+pH碱=13.
点评 本题考查了水的电离平衡分析,离子积常数的计算应用,注意离子积是一定温度下的常数,随温度改变,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用10ml量筒量取7.13ml稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 中和滴定时用去某浓度的碱溶液21.70mL |
| A. | lmolC2H8N2中含有lmolN2 | |
| B. | 偏二甲肼的摩尔质量为60g | |
| C. | 偏二甲肼是比液氢更环保的燃料 | |
| D. | 偏二甲肼燃烧时能放出大量的热和气体 |
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
| A. | 该溶液一定呈酸性 | B. | 该溶液中的c(H+)可能等于10-3 | ||
| C. | 该溶液的pH可能为2,可能为12 | D. | 该溶液有可能呈中性 |
| A. | Na+、Ba2+、Cl-、SO42- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | H+、Fe2+、NO3-、Cu2+ | D. | K+、AlO2-、CH3COO-、NO3- |