题目内容
15.下列关于丙烯(CH3-CH=CH2)的说法正确的( )| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
分析 A、甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
B、C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
C、同种非元素之间形成非极性键;
D、一个碳与四个不同原子或原子团相连.
解答 解:A、甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,所以丙烯分子中3个碳原子不是全部sp3杂化,故A错误;
B、C-C、C-H键均为σ键,C=C中一个σ键,一个π键,故B错误;
C、同种非元素之间形成非极性键,碳碳键是非极性键,碳氢键是极性键,故C正确;
D、一个碳与四个不同原子或原子团相连,CH3-CH=CH2分子中无手性碳,故D错误;
故选C.
点评 本题考查共价键及分类,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
6.已知:
(1)为了证明HF 是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究.
①甲同学取一定体积的HF溶液,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体观察到的现象是红色变浅,则证明HF 为弱酸.
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL.再测其pH 为b,若要认定HF 为弱酸,则a、b 应满足的关系是b<a+2(用含a 的代数式表示).
③丙同学用pH 试纸测得室温下0.10mol•L-1的HF 溶液的pH为2,则认定HF为弱酸,由丙同学的实验数据可得室温下HF 的电离平衡常数约为1.0×10-3.
(2)①己知H3BO3 与NaOH 溶液反应的离子方程式为H3BO3+OH-1=B(OH)4-,写出硼酸的电离方程式H3BO3+H2O?B(OH)4-+H+.
②向等浓度的H2C2O4与H3BO3混合溶液中逐滴加入NaoH 溶液,则与0H-作用的粒子(包括分子和离子)依次为H2C2O4,HC2O4-,H3BO3.
(3)向NaHC2O4 溶液中加入少量的Na2CO3溶液,反应的离子方程式2HC2O4-十CO32-=2C2O42-+H2O+CO2↑.
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
①甲同学取一定体积的HF溶液,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体观察到的现象是红色变浅,则证明HF 为弱酸.
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL.再测其pH 为b,若要认定HF 为弱酸,则a、b 应满足的关系是b<a+2(用含a 的代数式表示).
③丙同学用pH 试纸测得室温下0.10mol•L-1的HF 溶液的pH为2,则认定HF为弱酸,由丙同学的实验数据可得室温下HF 的电离平衡常数约为1.0×10-3.
(2)①己知H3BO3 与NaOH 溶液反应的离子方程式为H3BO3+OH-1=B(OH)4-,写出硼酸的电离方程式H3BO3+H2O?B(OH)4-+H+.
②向等浓度的H2C2O4与H3BO3混合溶液中逐滴加入NaoH 溶液,则与0H-作用的粒子(包括分子和离子)依次为H2C2O4,HC2O4-,H3BO3.
(3)向NaHC2O4 溶液中加入少量的Na2CO3溶液,反应的离子方程式2HC2O4-十CO32-=2C2O42-+H2O+CO2↑.
3.由CO2、H2组成的混合气体在同温、同压下与氮气的密度相同,则该混合气体中CO2、H2的体积比为( )
| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
20.下列有关物质的分类全部正确的一组是( )
| 非电解质 | 混合物 | 氧化物 | 弱电解质 | |
| A | Cu | 淀粉 | CuO | HClO |
| B | SO3 | 水玻璃 | Na2O•CaO•6SiO2 | H3PO4 |
| C | CH3CH2OH | KAl(SO4)2•12H2O | KClO3 | NH3•H2O |
| D | 葡萄糖 | 普通玻璃 | H2O | H2S |
| A. | A | B. | B | C. | C | D. | D |
7.某溶液中含有Fe3+、Fe2+,可用于检验该溶液中存在Fe2+的试剂是( )
| A. | 硫氰酸钾溶液 | B. | NaOH溶液 | ||
| C. | 新制氯水、硫氰酸钾溶液 | D. | 酸性KMnO4溶液 |
4.对Na2O2与CO2方和H2O(g)混合气体的反应来说,下列说法错误的是.
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
16.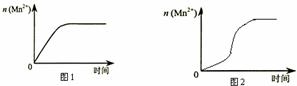 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是 与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
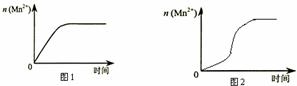 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
(1)补充上表中的实验数据:V1=3.0mL,V2=1.0mL,由表中数据可以得到的结论是 其他条件相同时,增大KMnO4浓度反应速率增大
(2)利用实验 1 中数据计算,用 KMnO4 的浓度变化表示的反应速率为 v(KMnO4)=1.5×10-2mol/(L•min)
(3)该小组同学根据经验绘制了 n(Mn2+)随时间变化趋势的示意图,如图 1 所示.但有同学查阅已有实验资 料发现,该实验过程中 n(Mn2+)随时间变化趋势应如图 2 所示,该小组同学根据图 2 所示信息提出了新的假 设,并继续进行实验探究
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
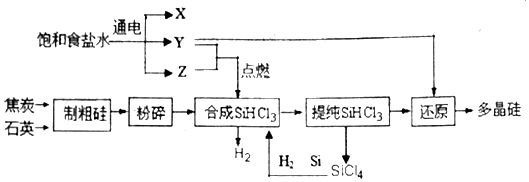
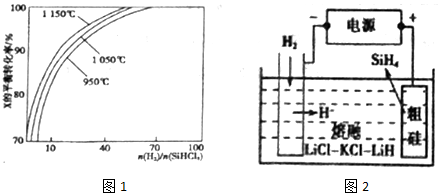
 回答下列问题
回答下列问题