题目内容
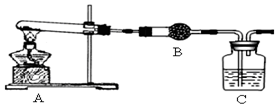
5.现用Zn与实验室中的盐酸反应制取4.48LH2(标准状况),求参加反应的锌的质量?分析 求出氢气的物质的量,然后根据1mol锌~2mol电子~1mol氢气,设消耗锌的物质的量为xmol,根据方程式来计算.
解答 解:生成的4.48L氢气的物质的量n=$\frac{4.48L}{22.4L/mol}$=0.2mol,设消耗锌的物质的量为xmol,可知:
1mol锌~2mol电子~1mol氢气
1 1
xmol 0.2mol
故有:$\frac{1}{xmol}=\frac{1}{0.2mol}$
解得x=0.2mol
故质量m=0.2mol×65g/mol=13g.
答:消耗锌的质量是13g.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量之间的关系式是解本题关键,为易错点.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
20.无机化合物可根据其组成和性质进行分类:
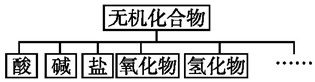
(1)上述所示物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
(3)写出⑦转化为⑤的化学方程式:2NaOH+CO2═Na2CO3+H2O.
(4)写出①与③反应的离子方程式:H++OH-=H2O.
(5)写出②与⑤反应的离子方程式:CO32-+2H+=H2O+CO2↑.
(6)书写下列反应的离子方程式
①Fe与CuSO4溶液反应:Fe+Cu2+=Cu+Fe2+;
②CaCO3和稀盐酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O.

(1)上述所示物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O |
(4)写出①与③反应的离子方程式:H++OH-=H2O.
(5)写出②与⑤反应的离子方程式:CO32-+2H+=H2O+CO2↑.
(6)书写下列反应的离子方程式
①Fe与CuSO4溶液反应:Fe+Cu2+=Cu+Fe2+;
②CaCO3和稀盐酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O.
17.下列说法中正确的是( )
| A. | 1mol•L-1的NaCl溶液是指由1mol NaCl和1000mL水配制成的溶液 | |
| B. | 从1L 0.5mol•L-1的NaCl溶液中取出100mL,剩余溶液物质的量浓度为0.45mol•L-1 | |
| C. | 标准状况下,18克H2O所含的氧原子数目为NA | |
| D. | 0℃时,2mol Cl2的体积不可能为22.4L |
6.在无色的酸性溶液中可以大量共存的离子组是( )
| A. | Fe2+ NO3- I-SO42- | B. | MnO4- K+NO3-Na+ | ||
| C. | K+Al3+Cl-SO42- | D. | Mg2+SO32-Br-Ba2+ |
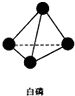 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA 回答下列问题
回答下列问题