题目内容
20.某学生的实验报告所列出的下列数据中合理的是( )| A. | 用10ml量筒量取7.13ml稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 中和滴定时用去某浓度的碱溶液21.70mL |
分析 A、量筒只能精确到0.1mL;
B、托盘天平只能精确到0.1g;
C、广泛pH试纸能精确到1;
D、滴定管精确到0.01mL.
解答 解:A、量筒只能精确到0.1mL,故用10mL量筒只能量取7.1mL的稀盐酸,故A错误;
B、托盘天平只能精确到0.1g,故用托盘天平只能精确到25.2g氯化钠,故B错误;
C、广泛pH试纸能精确到1,故广泛pH试纸测得溶液的pH为2,故C错误;
D、滴定管精确到0.01mL,故中和滴定时用去某浓度的碱溶液为21.70mL是合理的,故D正确.
故选D.
点评 本题考查了仪器的使用和精确度的问题,难度不大,应注意的是滴定管的精确度是仪器中最高的.

练习册系列答案
相关题目
10.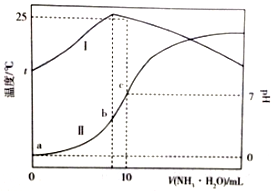 温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
 温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )| A. | c点时,c(NH3•H2O)=1.0mol•L-1 | B. | a点时,水的电离程度最大 | ||
| C. | b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c点时,c(NH3•H2O)=$\frac{x-1}{2}$mol•L-1 |
11.在标准状况下,若V LNH3中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
8.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol N2所含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 标准状况下,22.4 LHF所含的分子数为NA | |
| D. | 24 g O2分子和24 g O3分子所含的分子数不相等,氧原子数目相等 |
9.下列离子方程式书写正确的是( )
| A. | 碳酸钙与稀盐酸的反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡与稀硫酸的反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将小苏打加入到氢氧化钠溶液中:OH-+HCO3-═CO32-+H2O |
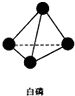 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA
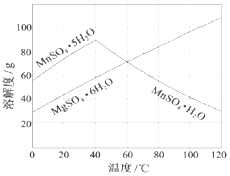 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4 回答下列问题
回答下列问题