题目内容
(1)在100℃时,PH=7呈 性.
(2)碳酸钠溶液呈碱性的原因,用离子方程式表示: .
(3)氯化铝溶液呈酸性的原因,用离子方程式表示:
(4)写电离方程式NaHCO3
(5)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式: .
(2)碳酸钠溶液呈碱性的原因,用离子方程式表示:
(3)氯化铝溶液呈酸性的原因,用离子方程式表示:
(4)写电离方程式NaHCO3
(5)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式:
考点:盐类水解的原理,电离方程式的书写,有关反应热的计算,水的电离
专题:
分析:(1)依据溶液中离子积常数可知,常温下Kw=10-14,升高温度促进水的电离,氢离子浓度增大,pH减小,中性溶液pH<7.
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性;
(3)氯化铝为强酸弱碱盐,铝离子水解导致溶液呈酸性;
(4)碳酸氢钠为强电解质,溶液中电离出钠离子和碳酸氢根离子;
(5)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性;
(3)氯化铝为强酸弱碱盐,铝离子水解导致溶液呈酸性;
(4)碳酸氢钠为强电解质,溶液中电离出钠离子和碳酸氢根离子;
(5)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
解答:
解:(1)常温下Kw=10-14,升高温度促进水的电离,氢离子浓度增大,pH减小,中性溶液pH<7,在100℃时,pH=7呈碱性,
故答案为:碱;
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)氯化铝为强酸弱碱盐,铝离子水解导致溶液呈酸性,水解方程式为Al3++3H3O?Al(OH)3+3H+,
故答案为:Al3++3H3O?Al(OH)3+3H+;
(4)碳酸氢钠属于强电解质,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-.
(5)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol,
故答案为:H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol;
故答案为:碱;
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)氯化铝为强酸弱碱盐,铝离子水解导致溶液呈酸性,水解方程式为Al3++3H3O?Al(OH)3+3H+,
故答案为:Al3++3H3O?Al(OH)3+3H+;
(4)碳酸氢钠属于强电解质,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-.
(5)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题考查电离、水解及其热化学方程式的书写,难度不大,注意掌握热化学方程式的书写,物质聚集状态的分析判断,题目较简单.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法正确的是( )
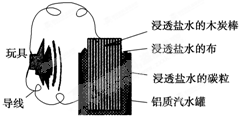

| A、铝罐将逐渐被腐蚀 |
| B、碳粒和炭棒上发生的反应为O2+4e-═2O2- |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和碳粒的质量会减轻 |
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:1的是( )
A、 |
B、 |
C、 |
D、 |
把Na投入CuSO4溶液中可能出现的现象是( )
①生成红色的物质 ②有气体生成 ③熔成小球 ④生成蓝色沉淀.
①生成红色的物质 ②有气体生成 ③熔成小球 ④生成蓝色沉淀.
| A、①③④ | B、②③④ |
| C、①④ | D、①③④ |
下列状态下的物质,既能导电又属于电解质的是( )
| A、MgCl2晶体 |
| B、NaCl溶液 |
| C、铜丝 |
| D、熔融的KOH |
下列反应的化学方程式或离子方程式表示正确的是( )
A、乙酸与乙醇的反应CH3COOH+CH3CH218OH
| ||||
| B、苯酚钠溶液和少量CO2反应:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | ||||
| C、用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
D、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH
|
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A、3种元素的气态氢化物中,Z的气态氢化物最稳定 |
| B、Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C、元素非金属性由弱到强的顺序为Z<Y<X |
| D、原子半径由大到小的顺序为X>Y>Z |
关于阿伏加德罗常数的说法正确的是( )
| A、0.1 L 3.0 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| B、9g SiO2晶体中含有的硅氧键数目为0.3NA |
| C、30 g甲醛中含共用电子对总数为4NA |
| D、10 g 46%的乙醇水溶液中所含H原子个数为0.6NA |