题目内容
15.常温下,关于下列溶液的说法错误的是( )| A. | 某物质的溶液中由水电离出的c(H+)=1×10-10mol/L,则该溶液的pH可能为4或10 | |
| B. | 已知0.1 mol/L NaClO溶液的pH为9.7,0.1 mol/LNaF溶液的pH为7.5,则等体积两溶液中离子总数大小关系为:N(NaClO)>N(NaF) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/LNaOH溶液等体积混合后溶液pH大于7,则所得溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | 向饱和氯水中加入NaOH溶液至pH=7,则所得溶液中:c(Na+)>c(Cl-)>c(C1O-)>c(OH-)=c(H+) |
分析 A.在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-10mol/L<10-7mol/L,说明该溶液中的溶质抑制了水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断;
B.根据pH判断水解程度,然后结合电荷守恒判断两溶液中含有阴离子数目大小;
C.根据混合液中的电荷守恒和物料守恒分析;
D.向饱和氯水中加入NaOH溶液,恰好反应时生成氯化钠和次氯酸钠,次氯酸钠水解会使溶液呈碱性,如果溶液呈中性,则加入的氢氧化钠不足,据此判断各离子浓度大小.
解答 解:A.在25℃时,溶液中由水电离出的c(H+)水=1.0×10-10 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,如果为酸溶液,溶液中的氢氧根离子是水电离的,水电离出的c(H+)水=c(OH-)=1.0×10-10 mol/L,溶液中的氢离子浓度为:c(H+)=1.0×10-4mol/L,则溶液的pH=4;如果为碱溶液,溶液中的氢离子是水电离的,c(H+)=1×10-10mol/L,则溶液的pH=10,故A正确;
B.NaClO、NaF溶液中次氯酸根离子、氟离子发生水解使溶液呈碱性,已知0.1 mol/L NaClO溶液的pH为9.7,0.1 mol/LNaF溶液的pH为7.5,说明次氯酸根的水解程度大于氟离子,则次氯酸钠溶液中氢氧根离子浓度大于氟化钠,故次氯酸钠溶液中的氢离子浓度小于氟化钠;两溶液中钠离子浓度相等,两溶液中阴离子浓度=c(Na+)+c(H+),由于溶液体积相等,则次氯酸钠溶液中阴离子数目小于氟化钠,即:N(NaClO)<N(NaF),故B错误;
C.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),根据物料守恒可得:2c(Na+)=c(HA)+c(A-),二者结合可得:2c(OH-)=2c(H+)+c(HA)-c(A-),故C正确;
D.反应后溶质为氯化钠和次氯酸钠时,次氯酸钠水解会使溶液呈碱性,若溶液呈中性,则加入的氢氧化钠不足,则有c(ClO-)<c(Cl-),溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(C1O-)>c(OH-)=c(H+),故D正确;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,注意掌握比较离子浓度大小常用方法,试题培养了学生的灵活应用能力.

| A. | 2 C(s)+O2(g)=2 CO(g)△H=-393.5 kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| D. | C6H12O6(s)+6 O2(g)=6 CO2(g)+6 H2O(l)△H=-2800 kJ/mol |
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 离子化合物一定不能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |

| A. | 非金属性:Y>Z>M | |
| B. | 原子半径:M>Z>Y | |
| C. | Z元素最高价氧化物的水化物的浓溶液具有强氧化性和难挥发性 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
| A. | pH=2的CH3COOH 溶液与pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(CH3COOH) | |
| B. | pH=3的H2C2O4溶液:c(H+)═c(HC2O4-)+c(OH-)=1×10-3mol/L | |
| C. | pH相同的①NH4HSO4、②NH4Cl、③(NH4)2SO4三种溶液的c(NH4+):③>①>② | |
| D. | 盐酸与FeCl3的混合溶液pH=2,稀释10倍后:pH<3 |
| A. | Fe3+ | B. | NH4+ | C. | OH- | D. | Cl- |
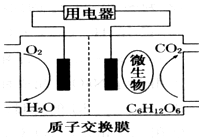 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | O2在正极反应 | |
| C. | H+通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
| A. |  稀释浓硫酸 | B. |  闻气体的气味 | C. |  滴加液体 | D. |  过滤液体 |