题目内容
4.将15.68L(标准状况)的氯气通入70℃.500mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸钠.若取此溶液25mL,稀释到250mL,再取稀释后的溶液25mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾.用浓度为0.20mol/L硫代硫酸钠(Na2S2O3)测定析出的碘:I2+2Na2S2O3=2NaI+Na2S4O6,需用硫代硫酸钠溶液5.0mL.将上述测定后的溶液再用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘再用上述硫代硫酸钠测定,又用了30.0mL.(1)计算反应后溶液中次氯酸钠和氯酸钠的物质的量之比.
(2)用一个总化学方程式表示题中氯气通入70℃氢氧化钠溶液中所发生的化学反应.
(3)假设题中氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,请计算通入氯气后各生成物的物质的量浓度.
分析 (1)根据关系式ClO-~2I-~I2~2S2O32-、ClO3-~6I-~3I2 ~6S2O32-计算出次氯酸钠和氯酸钠的物质的量,据此解答;
(2)氯气与氢氧化钠溶液反应生成NaCl、NaClO、NaClO3与水,结合NaClO、NaClO3的物质的量关系,配平书写方程式;
(3)计算氯气的物质的量,根据方程式计算反应后n(NaClO)、n(NaClO3)、n(NaCl),进而计算各自的浓度.
解答 解:(1)用醋酸酸化,只有次氯酸钠氧化碘化钾,消耗Na2S2O3溶液5.0mL,根据关系式:ClO-~2I-~I2~2S2O32-,则n(NaClO)=n(I2)=$\frac{1}{2}$×n(S2O32-)=$\frac{1}{2}$×0.20mol/L×0.005L=0.0005mol;
用盐酸酸化至强酸性,氯酸钾氧化碘化钠,消耗Na2S2O3溶液30.00mL;根据关系式:ClO3-~6I-~3I2 ~6S2O32-,则n(NaClO3)=$\frac{1}{6}$n(S2O32-)=$\frac{1}{6}$×0.20mol/L×0.03L=0.001mol;
故n(NaClO):n(NaClO3)=0.0005mol:0.001=1:2;
故答案为:1:2;
(2)氯气与氢氧化钠溶液反应生成NaCl、NaClO、NaClO3与水,n(NaClO):n(NaClO3)=1:2,则反应总方程式为:7Cl2+14NaOH=2NaClO3+NaClO+11NaCl+7H2O,
故答案为:7Cl2+14NaOH=2NaClO3+NaClO+11NaCl+7H2O;
(3)15.68L(标准状况)Cl2 的物质的量是:15.68 L÷22.4 L•mol-1=0.7mol,
7 Cl2+14 NaOH=2 NaClO3+NaClO+11 NaCl+7H2O
7 2 1 11
0.7mol n(NaClO3) n(NaClO) n(NaCl)
n(NaClO3)=$\frac{0.7mol×2}{7}$=0.2mol
n(NaClO)=$\frac{0.7mol×1}{7}$=0.1mol
n(NaCl)=$\frac{0.7mol×11}{7}$=1.1mol
则:c(NaClO)=$\frac{0.1mol}{0.5L}$=0.2mol/L
c(NaClO3)=$\frac{0.2mol}{0.5L}$=0.4mol/L
c(NaCl)=$\frac{1.1mol}{0.5L}$=2.2mol/L
故答案为:c(NaClO)=0.2mol/L;c(NaClO3)=0.4mol/L;(NaCl)=2.2mol/L.
点评 本题考查了有关氧化还原反应计算,明确发生反应实质,准确把握各反应物量之间的关系是解题关键,侧重考查学生分析计算能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 离子化合物一定不能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
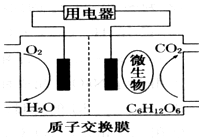 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | O2在正极反应 | |
| C. | H+通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
| A. | ≥1 | B. | ≤1 | C. | =1 | D. | <1 |
①量筒 ②表面皿 ③烧杯 ④试管⑤容量瓶 ⑥蒸发皿 ⑦坩埚 ⑧烧瓶.
| A. | ②③④⑥⑦⑧ | B. | ③⑥⑧ | C. | ④⑥⑦ | D. | ④⑦⑧ |
| A. |  稀释浓硫酸 | B. |  闻气体的气味 | C. |  滴加液体 | D. |  过滤液体 |
| A. | 将1molCl2溶入足量的水中,溶液里HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 3.4g NH3中共用电子对数为0.6NA | |
| C. | 相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等 | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |