题目内容
现有A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期.A元素原子的价层电子总数是内层电子总数的2倍;C元素原子的L电子层中只有两对成对电子; E元素与D元素在同周期相邻的族,原子序数相差3,且E元素没有在d区.请回答下列问题:
(1)B、C两种元素的第一电离能较大的是 (用元素符号表示),试解释其原因 .
(2)D元素原子的价层电子排布图为: .D元素形成的单质,其晶胞结构如图1中 所示,E元素形成的单质,其晶胞结构如图1中 所示.
(3)A元素与氢元素能形成种类繁多的化合物,其中同时含sp杂化、sp2杂化、sp3杂化且相对分子质量最小的稳定化合物的化学式为 .
(4)另有一种元素X,已知A与X的原子序数之和为10,用阴离子树脂交换法可提取一种组成元素为氯和X的阴离子,该阴离子内有一个X原子且最外层达到8电子稳定结构,则该阴离子的结构式为 .
(5)由A元素形成的某种晶体,其晶胞结构如图2所示,已知阿伏伽德罗常数为NA,晶胞边长为a pm,则该晶体的密度是 g?cm-3.

(1)B、C两种元素的第一电离能较大的是
(2)D元素原子的价层电子排布图为:
(3)A元素与氢元素能形成种类繁多的化合物,其中同时含sp杂化、sp2杂化、sp3杂化且相对分子质量最小的稳定化合物的化学式为
(4)另有一种元素X,已知A与X的原子序数之和为10,用阴离子树脂交换法可提取一种组成元素为氯和X的阴离子,该阴离子内有一个X原子且最外层达到8电子稳定结构,则该阴离子的结构式为
(5)由A元素形成的某种晶体,其晶胞结构如图2所示,已知阿伏伽德罗常数为NA,晶胞边长为a pm,则该晶体的密度是
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期.A元素原子的价层电子总数是内层电子总数的2倍,原子只能有2个电子层,价电子数目为4,则A为碳元素;C元素原子的L电子层中只有两对成对电子,其原子核外电子排布为1s22s2p4,则C为O元素;结合原子序数可知B为N元素;
E元素与D元素在同周期相邻的族,原子序数相差3,二者处于第四周期,为Ⅷ族元素与ⅦB(或ⅠB)元素,且E元素没有在d区,可推知D为Fe、E为Cu,据此解答.
E元素与D元素在同周期相邻的族,原子序数相差3,二者处于第四周期,为Ⅷ族元素与ⅦB(或ⅠB)元素,且E元素没有在d区,可推知D为Fe、E为Cu,据此解答.
解答:
解:A、B、C、D、E原子序数依次增大的五种元素,它们位于元素周期表的前四周期.A元素原子的价层电子总数是内层电子总数的2倍,原子只能有2个电子层,价电子数目为4,则A为碳元素;C元素原子的L电子层中只有两对成对电子,其原子核外电子排布为1s22s2p4,则C为O元素;结合原子序数可知B为N元素;
E元素与D元素在同周期相邻的族,原子序数相差3,二者处于第四周期,为Ⅷ族元素与ⅦB(或ⅠB)元素,且E元素没有在d区,可推知D为Fe、E为Cu,
(1)同周期随原子序数增大元素第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于O元素,
故答案为:N;N的2p轨道为半充满状态,与O相比体系能量更低,更稳定,故第一电离能更大;
(2)D为Fe元素,原子核外电子数为26,基态原子的核外价层电子排布式为3d64s2,价电子排布图为: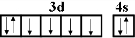 ,Fe元素形成的单质,其晶胞结构为体心立方堆积,如图1中乙所示,Cu元素形成的单质,其晶胞结构为面心立方密堆积,如图1中丙所示.
,Fe元素形成的单质,其晶胞结构为体心立方堆积,如图1中乙所示,Cu元素形成的单质,其晶胞结构为面心立方密堆积,如图1中丙所示.
故答案为: ;乙;丙;
;乙;丙;
(3)C元素与氢元素能形成种类繁多的化合物,其中同时含sp杂化、sp2杂化、sp3杂化且相对分子质量最小的稳定化合物为CH3CH=CHC≡CH,分子式为C5H6,
故答案为:C5H6;
(4)另有一种元素X,已知A与X的原子序数之和为10,则X原子序数为4,为Be元素,用阴离子树脂交换法可提取一种组成元素为氯和X的阴离子,阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,则该阴离子的结构式为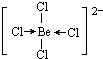 ,
,
故答案为: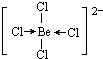 ;
;
(5)晶胞中碳原子数目=4+6×
+8×
=8,故晶胞质量=8×
g,晶胞边长为a pm,则晶胞体积=(a×10-10cm)3=a3×10-30cm3,则该晶体的密度=
=
g?cm-3,
故答案为:
.
E元素与D元素在同周期相邻的族,原子序数相差3,二者处于第四周期,为Ⅷ族元素与ⅦB(或ⅠB)元素,且E元素没有在d区,可推知D为Fe、E为Cu,
(1)同周期随原子序数增大元素第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于O元素,
故答案为:N;N的2p轨道为半充满状态,与O相比体系能量更低,更稳定,故第一电离能更大;
(2)D为Fe元素,原子核外电子数为26,基态原子的核外价层电子排布式为3d64s2,价电子排布图为:
 ,Fe元素形成的单质,其晶胞结构为体心立方堆积,如图1中乙所示,Cu元素形成的单质,其晶胞结构为面心立方密堆积,如图1中丙所示.
,Fe元素形成的单质,其晶胞结构为体心立方堆积,如图1中乙所示,Cu元素形成的单质,其晶胞结构为面心立方密堆积,如图1中丙所示.故答案为:
 ;乙;丙;
;乙;丙;(3)C元素与氢元素能形成种类繁多的化合物,其中同时含sp杂化、sp2杂化、sp3杂化且相对分子质量最小的稳定化合物为CH3CH=CHC≡CH,分子式为C5H6,
故答案为:C5H6;
(4)另有一种元素X,已知A与X的原子序数之和为10,则X原子序数为4,为Be元素,用阴离子树脂交换法可提取一种组成元素为氯和X的阴离子,阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,则该阴离子的结构式为
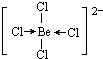 ,
,故答案为:
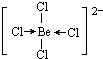 ;
;(5)晶胞中碳原子数目=4+6×
| 1 |
| 2 |
| 1 |
| 8 |
| 12 |
| NA |
8×
| ||
| a3×10-30cm3 |
| 9.6×1031 |
| a3×NA |
故答案为:
| 9.6×1031 |
| a3×NA |
点评:本题考查物质结构与性质,涉及核外电子排布、电离能、分子结构与性质、杂化轨道、晶胞结构等,注意识记理解中学常见的晶胞结构,难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
某元素原子最外层电子层上只有一个电子,该元素( )
| A、一定是金属元素 |
| B、可能是金属元素,也可能不是金属元素 |
| C、一定是ⅠA族元素 |
| D、一定是非主族元素 |
北京奥运会“祥云”火炬使用的燃料为丙烷.下列关于丙烷的说法正确的是( )
| A、1mol丙烷完全燃烧需4mol氧气 |
| B、与丁烷互为同分异构体 |
| C、能使酸性高锰酸钾溶液褪色 |
| D、分子式为C3H8 |
下列操作能实现的是( )
| A、用氨水清洗做过银镜反应的试管 |
| B、向放有电石的圆底烧瓶中,滴入饱和食盐水可产生乙炔气体 |
| C、将2%的NaOH溶液4至5滴,滴入2mL 10%的CuSO4溶液中制得Cu(OH)2悬浊液,加入乙醛溶液加热,用以检验醛基存在 |
| D、已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |


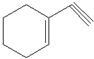 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有 )发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为
)发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为