题目内容
【题目】某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。
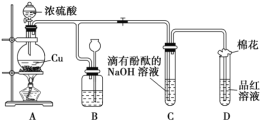
(1)装置A中发生的化学反应的化学方程式为________________________________。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________(填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____________性。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____________。
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________mol(用含d的代数式表示)。
(6)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
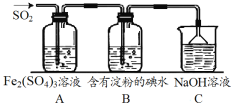
在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_________,(填①或②)不合理的原因是____________。
(7)在上述装置中能表明SO2的还原性强于I2的现象是____________。
【答案】Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O ② 漂白(或漂白性) 吸收多余的SO2防止污染环境 d/80 (或0.0125d 、1.25×10-2d等 ) ① 过量的SO2能与高锰酸钾溶液反应,使紫色褪去(或亚硫酸与高锰酸钾溶液反应,使紫色褪去) B中溶液蓝色褪去
【解析】
浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,反应生成的SO2具有酸性和还原性,可用排饱和NaHSO3溶液收集,具有漂白性,可使品红溶液褪色,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应,结合题目要求和相关物质的性质解答该题。
CuSO4+SO2↑+2H2O,反应生成的SO2具有酸性和还原性,可用排饱和NaHSO3溶液收集,具有漂白性,可使品红溶液褪色,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应,结合题目要求和相关物质的性质解答该题。
(1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)SO2易溶于水,具有酸性和还原性,可与酸性KMnO4、Na2SO3溶液反应,难溶于水饱和的NaHSO3溶液,可用排饱和NaHSO3溶液收集,故答案为②;
(3)SO2溶液具有酸性,可与NaOH溶液反应,发生:SO2+2OH-=SO32-+H2O,则滴加酚酞的氢氧化钠溶液褪色,具有漂白性,可使品红溶液褪色;
(4)二氧化硫有毒,不能排放到空气中,能与氢氧化钠溶液反应,则棉花上可浸有氢氧化钠溶液,防止污染空气;
(5)浓H2SO4与铜反应的过程中,浓度会变稀,而稀硫酸不与铜反应,所以会有剩余,加入硝酸钾后,硝酸根离子在氢离子存在情况下有强氧化性,能与铜反应,剩余硫酸浓度为dmol/L,则硫酸物质的量=0.025L×dmol/L=0.025dmol,由离子反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知反应消耗硝酸钾的物质的量为0.025mol×2![]() =0.0125dmol;
=0.0125dmol;
(6)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,故答案为方案①,不合理的原因是过量的SO2也能使KMnO4溶液褪色;
(7)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,故能表明SO2的还原性强于I2的现象是装置B中溶液蓝色褪去。