题目内容
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:
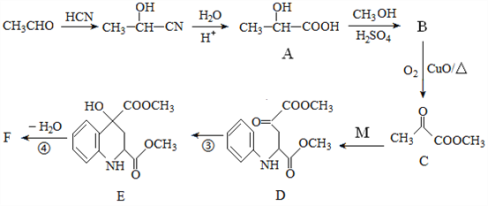
已知:M的结构简式为: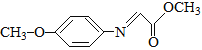 。
。
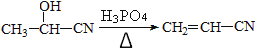
请回答下列问题:
(1)A的化学名称是_______________,③的反应类型是___________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:_____________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
①能够发生银镜反应。
②含有硝基(–NO2),且硝基直接连在苯环上。
③含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
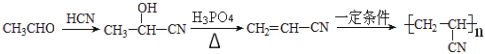
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):____________
【答案】2-羟基丙酸(或α-羟基丙酸或乳酸) 加成反应 羰基(酮基),酯基 
![]() 15
15 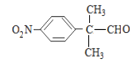
【解析】
(1)A属于羧酸,2号C原子中有1个羧基,故名称为2-羟基丙酸(或α-羟基丙酸或乳酸); 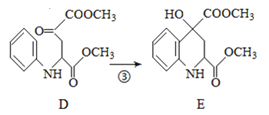 由D、E比较可得D中与酯基相连的羰基与氢气发生了加成反应生成E;
由D、E比较可得D中与酯基相连的羰基与氢气发生了加成反应生成E;
正确答案:2-羟基丙酸(或α-羟基丙酸或乳酸) ;加成反应。
(2)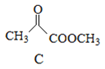 通过观察可知C的官能团为羰基(酮基),酯基;
通过观察可知C的官能团为羰基(酮基),酯基;
正确答案:羰基(酮基),酯基。
(3)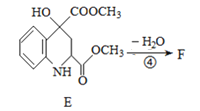 由于E到F失去水,考虑到醇的消去反应,所以得出F的结构简式
由于E到F失去水,考虑到醇的消去反应,所以得出F的结构简式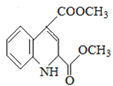 ;
;
正确答案: 。
。
(4)已知A在一定条件下能生成可降解的聚酯,该反应化学方程式:![]()
正确答案:![]()
(5)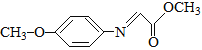 (M)的同分异构体满足①能够发生银镜反应,必有-CHO②含有硝基(–NO2),且硝基直接连在苯环上。③含有苯环且苯环上只有两个取代基。由以上条件确定官能团情况有五种:
(M)的同分异构体满足①能够发生银镜反应,必有-CHO②含有硝基(–NO2),且硝基直接连在苯环上。③含有苯环且苯环上只有两个取代基。由以上条件确定官能团情况有五种:
第一种:–NO2、–CH2 CH2 CH2CHO,第二种:–NO2、–CH(CH3)CH2CHO,第三种:–NO2、–CH2 CH(CH3)CHO,第四种:–NO2、–C(CH3)2CHO 第五种:–NO2、–CH(CH2CH3)CHO,五种情况中的两个取代基分别位于苯环的邻,间,对位,共3×5=15种;
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为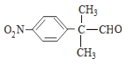 ;
;
正确答案:15、 。
。
(6)由信息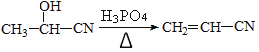 采用逆推法去思考同时注意观察题干中合成路线可得答案:
采用逆推法去思考同时注意观察题干中合成路线可得答案:![]()
正确答案:![]() 。
。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。