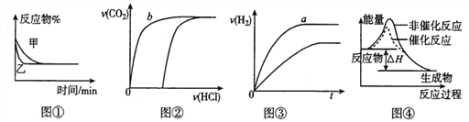
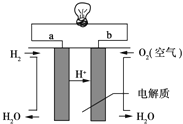
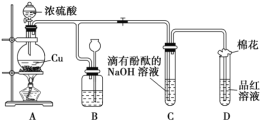
题目内容
【题目】下列物质中含有氧离子的是
A.H2OB.KOHC.H2O2D.CaO
【答案】D
【解析】
A.水是共价化合物,水中氧原子和氢原子之间只存在共价键,无氧离子,故A不符合题意;
B.氢氧化钾是离子化合物,氢氧化钾中存在的化学键是由钾离子和氢氧根离子形成的离子键,无氧离子,故B不符合题意;
C.H2O2是共价化合物,分子中氧原子和氢原子之间、氧原子和氧原子之间都只存在共价键,不存在氧离子,故C不符合题意;
D.CaO是离子化合物,氧化钙中存在的化学键是由钙离子和氧离子形成的离子键,存在氧离子,故D符合题意;
故答案为:D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目