题目内容
2.(1)欲除去SO2中的HCl,可用试剂饱和NaHSO3溶液(2)除去混入Fe2O3中少量SiO2杂质的试剂是NaOH溶液,该反应的离子方程式为SiO2+2OH-=SiO32-+H2O.
分析 (1)HCl与饱和亚硫酸氢钠反应生成二氧化硫;
(2)SiO2与NaOH反应,而氧化铁不能,以此来解答.
解答 解:(1)HCl与饱和亚硫酸氢钠反应生成二氧化硫,选择试剂为饱和NaHSO3溶液,故答案为:饱和NaHSO3溶液;
(2)SiO2与NaOH反应,而氧化铁不能,选择试剂为NaOH溶液,发生的离子反应为SiO2+2OH-=SiO32-+H2O,故答案为:NaOH溶液;SiO2+2OH-=SiO32-+H2O.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
17.在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3mol•L-1、0.15mol•L-1,向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
| A. | 0.15 mol•L-1 | B. | 0.225 mol•L-1 | C. | 0.30 mol•L-1 | D. | 0.45 mol•L-1 |
18.下列各组溶液中离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、NO3- |
10.根据如图海水综合利用的工业流程图,判断下列说法正确的是
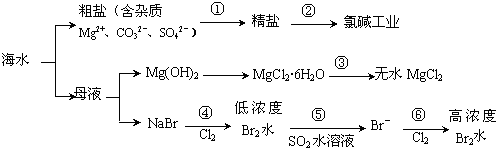
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.( )

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.( )
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
17.某温度时,发生反应2HI (g)?H2 (g)+I2 (g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是( )
| A. | 平衡时,各容器的压强:②=①=③ | B. | 平衡时,I2的浓度:②>①=③ | ||
| C. | 平衡时,I2的体积分数:②=①=③ | D. | 从反应开始到达平衡的时间:①>②=③ |
7.下列有关描述中正确的是( )
| A. | 牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 | |
| B. | AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同 | |
| C. | 室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
14.粗盐提纯使用的主要仪器有( )
| A. | 漏斗、烧杯、蒸发皿、酒精灯 | B. | 量筒、烧杯、试管夹、蒸发皿 | ||
| C. | 玻璃棒、蒸发皿、漏斗、集气瓶 | D. | 铁架台、天平、长颈漏斗、酒精灯 |
12.下列各组离子方程式可用H++OH-═H2O表示的是( )
| A. | 硫酸溶液中和氢氧化钠溶液 | B. | 硫酸溶液中和氢氧化钡溶液 | ||
| C. | 盐酸溶解氧化铜 | D. | 盐酸溶解氢氧化镁 |