题目内容
10.根据如图海水综合利用的工业流程图,判断下列说法正确的是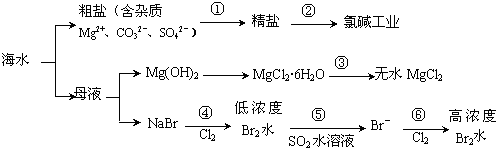
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.( )
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴,
A.过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,根据镁离子水解显酸性进行分析;
C.根据反应⑤二氧化硫与溴单质的生成产物进行分析;
D.气体存在的条件未知,不能确定体积.
解答 解:A.过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程;过程②电解饱和食盐水获得了氯气和氢气两种单质,故A错误;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2•6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C.因Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,故C正确;
D.因2Br-+Cl2 =Br2 +2Cl-,每氧化0.2molBr-需消耗0.1molCl2,温度压强不知不能计算氯气的体积,故D错误.
故选C.
点评 本题考查了海水资源综合利用,为高频考点,侧重考查学生的分析、实验能力,涉及了离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,题目难度中等.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
5.下列化合物中,能通过单质与酸反应或单质间化合直接制取的是( )
| A. | CuCl2 | B. | FeCl2 | C. | AlCl3 | D. | FeCl3 |
3.下列有关实验操作、发生的现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 发生的现象 | 解释或结论 |
| A | 向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的亚硫酸钡是难溶解于水的沉淀 |
| B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入硝酸中 | 产生白色沉淀 | 常温下铜和硝酸一定产生NO2 |
| D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
| A. | A | B. | B | C. | C | D. | D |
5. 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00 mL 时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)}$>1 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |
15.1mol氨气(化学式为:NH3)分解成氮气和氢气要吸收46.19kJ的热量,下列热化学方程式中正确的是( )
| A. | 2NH3=N2+3H2-46.19kJ | B. | 2NH3(g)=N2(g)+3H2(g)-46.19kJ | ||
| C. | NH3(g)=$\frac{1}{2}{N_2}$(g)+$\frac{3}{2}{H_2}$(g)-46.19kJ | D. | 2NH3(g)=N2(g)+3H2(g)+92.38kJ |
19.用 0.50mol•L-1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
| A. | 若选用酚酞作指示剂,终点时,液体恰好褪色 | |
| B. | 用量筒量取上述盐酸 | |
| C. | 若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大 | |
| D. | 盐酸的浓度为1.00 mol•L-1 |
20.下列物质中,是人体必需的营养成分之一,给人体提供能量的是( )
| A. | 食盐 | B. | 水 | C. | 糖类 | D. | 陈醋 |
 2PbSO4+2H2O.
2PbSO4+2H2O.